inlärningsmål
- definiera korrosion
- lista några av de metoder som används för att förhindra eller sakta korrosion
korrosion definieras vanligtvis som metallförstöring på grund av en elektrokemisk process. Bildandet av rost på järn, Matt på silver och den blågröna patina som utvecklas på koppar är alla exempel på korrosion., Den totala kostnaden för korrosion i USA är signifikant, med uppskattningar över en halv biljon dollar per år.
kanske är det mest kända exemplet på korrosion bildandet av rost på järn. Järn kommer att rosta när det utsätts för syre och vatten. De viktigaste stegen i rost av järn verkar innebära följande (figur 2). När de utsätts för atmosfären oxiderar järn snabbt.
elektronerna minskar syre i luften i sura lösningar.
vad vi kallar rost är hydratiserat järn(III) oxid, som bildas när järn (II) joner reagerar ytterligare med syre.,
antalet vattenmolekyler är variabel, så det representeras av x. till skillnad från patina på koppar skapar rostbildning inte ett skyddande skikt och så fortsätter korrosionen av järnet när rostflakorna av och exponerar färskt järn i atmosfären.
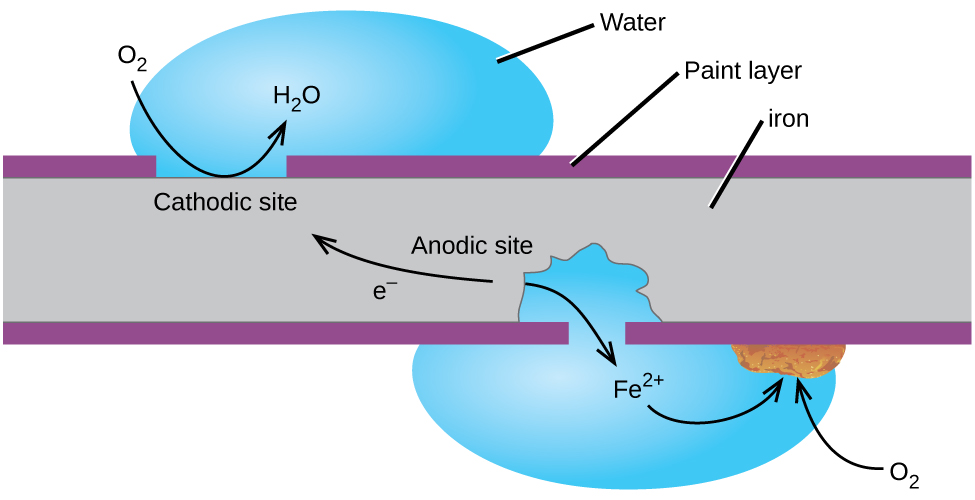
ett sätt att hålla järnet frätande är att hålla det målat. Färgskiktet förhindrar att vatten och syre som är nödvändigt för rostbildning kommer i kontakt med järnet. Så länge färgen förblir intakt, är järnet skyddat mot korrosion.,
andra strategier inkluderar legering av järn med andra metaller. Till exempel är rostfritt stål mestadels järn med lite krom. Kromet tenderar att samlas nära ytan, där det bildar ett oxidskikt som skyddar järnet.
förzinkat eller galvaniserat järn använder en annan strategi. Zink oxideras lättare än järn eftersom zink har en lägre reduktionspotential. Eftersom zink har en lägre reduktionspotential är det en mer aktiv metall. Således, även om zinkbeläggningen är repad, kommer zinken fortfarande att oxidera före järnet., Detta tyder på att detta tillvägagångssätt bör fungera med andra aktiva metaller.
ett annat viktigt sätt att skydda metall är att göra den till katoden i en galvanisk cell. Detta är katodiskt skydd och kan användas för andra metaller än bara järn. Till exempel kan rost av underjordiska järnlagringstankar och rör förebyggas eller minskas kraftigt genom att ansluta dem till en mer aktiv metall som zink eller magnesium (Figur 3). Detta används också för att skydda metalldelarna i vattenvärmare., De mer aktiva metallerna (lägre reduktionspotential) kallas offeranoder eftersom de blir vana när de korroderar (oxiderar) vid anoden. Metallen som skyddas fungerar som katoden, och oxiderar inte (korroderar). När anoderna övervakas ordentligt och regelbundet ersätts, kan den användbara livslängden på järnlagringstanken förlängas kraftigt.
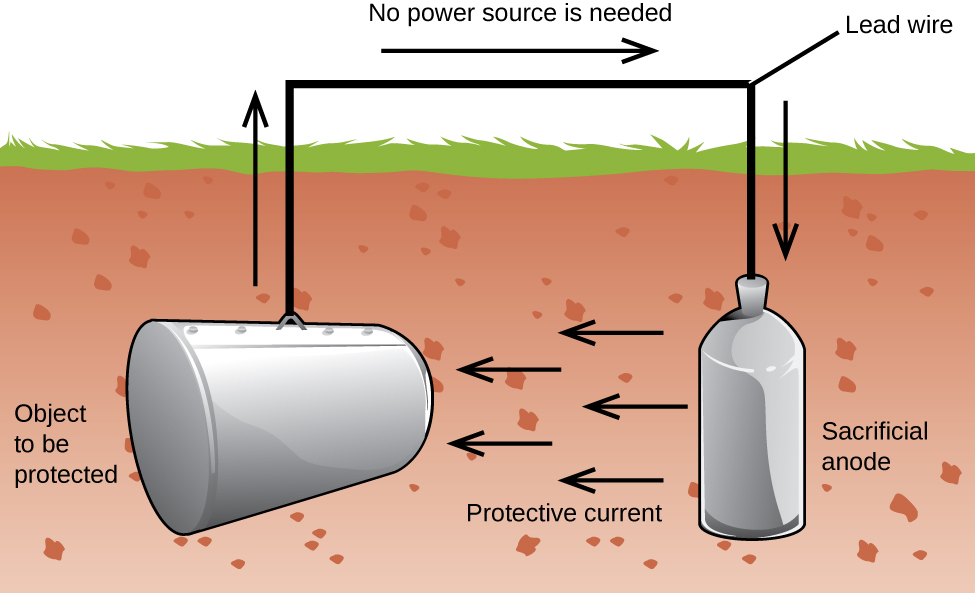
korrosion är nedbrytningen av en metall som orsakas av en elektrokemisk process. Stora summor pengar spenderas varje år reparera effekterna av, eller förebygga, korrosion. Vissa metaller, såsom aluminium och koppar, producerar ett skyddande skikt när de korroderar i luft., Det tunna skiktet som bildas på metallets yta förhindrar att syre kommer i kontakt med mer av metallatomerna och därmed ”skyddar” den återstående metallen från ytterligare korrosion. Järn korroderar (bildar rost) vid exponering för vatten och syre. Rost som bildas på järn metall flingor av, utsätta färsk metall, som också korroderar. Ett sätt att förhindra, eller långsam, korrosion är genom att belägga metallen. Beläggning förhindrar att vatten och syre kommer i kontakt med metallen. Färg eller andra beläggningar kommer att sakta korrosion, men de är inte effektiva en gång repad., Zinkpläterat eller galvaniserat järn utnyttjar det faktum att zink är mer sannolikt att oxidera än järn. Så länge beläggningen kvarstår, även om repad, kommer zinken att oxidera före järnet. En annan metod för att skydda metaller är katodiskt skydd. I denna metod är en lätt oxiderad och billig metall, ofta zink eller magnesium (offeranoden), elektriskt ansluten till metallen som måste skyddas. Den mer aktiva metallen är offeranoden och är anoden i en galvanisk cell. Den” skyddade ” metallen är katoden och förblir ooxiderad., En fördel med katodiskt skydd är att offeranoden kan övervakas och bytas ut om det behövs.,
ordlista
katodisk skyddsmetod för att skydda metall genom att använda en offeranod och effektivt göra den metall som behöver skydda katoden, vilket förhindrar dess oxidation korrosion nedbrytning av metall genom en elektrokemisk process galvaniserat järn metod för att skydda järn genom att täcka den med zink, som kommer att oxidera före järnet; förzinkad järn offer anod mer aktiv, billig metall som används som anod i katodskydd; ofta tillverkad av magnesium eller zink
lösningar
svar på kemi slutet av kapitel övningar
2., Mg och Zn
4. Båda exemplen innefattar katodiskt skydd. Den (offer) anoden är den metall som korroderar (oxiderar eller reagerar). När det gäller järn (-0.447 V) och zink (-0.7618 V) har zink en mer negativ standardreduceringspotential och fungerar sålunda som anoden. När det gäller järn och koppar (0,34 V) har järn den mindre standardreduceringspotentialen och korroderar därför (fungerar som anoden).
6., Även om litiums reduktionspotential skulle göra det möjligt att skydda de andra metallerna, är denna höga potential också en indikation på hur reaktivt litium är; det skulle ha en spontan reaktion med de flesta ämnen. Detta innebär att litium skulle reagera snabbt med andra ämnen, även de som inte skulle oxidera metallen den försöker skydda. Reaktivitet som detta innebär att offeranoden skulle vara utarmad snabbt och måste bytas ut ofta. (Valfritt ytterligare skäl: brandrisk i närvaro av vatten.)