introduktion
Kärnfaktor kappa B (NF-kB) är en gammal proteintranskriptionsfaktor (Salminen et al., 2008) och anses vara en regulator av medfödd immunitet (Baltimore, 2009). NF-kB-signaleringsvägen länkar patogena signaler och cellulära farosignaler, vilket organiserar cellulär resistens mot invaderande patogener., I själva verket, en uppsjö av studier har visat NF-kB hub är ett nätverk som ansvarar för komplexa biologiska signalsystem (Albensi och Mattson, 2000; Kaltschmidt och Kaltschmidt, 2009; Karin, 2009). För detta ändamål har NF-kB hypotes vara en huvudregulator för evolutionärt bevarade biokemiska kaskader (Mattson et al., 2000). Andra faktorer translokeras också till mitokondrier och är involverade i modulerande uttryck (Barshad et al., 2018a), men är inte i fokus för denna översyn., Syftet med denna översyn är att försöka förstå hur NF-kB-aktivitet bidrar till mitokondriell funktion. Det antas att läsaren redan har en förståelse för grundläggande mitokondriell biologi. I händelse av att ytterligare studera, hänvisas läsaren till många bra studier och recensioner på mitokondrie-struktur och funktion (Hall, 1979; Fox, 1982; Roger och Silberman, 2002; Henze och Martin, 2003; Conradt, 2006; Ettema, 2016, Wang och Youle, 2016; Barshad et al., 2018b).,
NF-kB aktivering
nukleär faktor kappa B-subenheter, innefattande NF-kB-komplexet, uttrycks i både neuroner och glia. NF-kB-komplexet finns i ett inaktivt tillstånd i cytoplasman (Ghosh et al., 1998; Aggarwal et al., 2004; Hayden och Ghosh, 2004) där aktivering av NF-kB har beskrivits väl (Li och Karin, 2000; Baud och Jacque, 2008; Israel, 2010). När det stimuleras av molekyler som TNFa eller andra cellspännare binds TNFa till TNF-receptorer (Figur 1)., Denna bindning, via flera mellanliggande steg, leder till en interaktion med IkB-kinaskomplexet (IKK), vilket sedan leder till fosforylering av IkB, och resulterar därefter i IkB ubiquitination och nedbrytning. När den bryts ned, översätter den återstående NF-kB dimer (t.ex. P65/P50-subenheter) till kärnan, där den binder till DNA-konsensussekvensen av olika målgener. Selektiviteten hos NF-kB-svaret baseras på flera faktorer (Sen och Smale, 2010) inklusive dimerkomposition, timing och celltyp., NF-KBS påverkan på cellöverlevnaden är också komplex och kan vara neuroprotektiv eller proinflammatorisk, beroende på celltyp, utvecklingsstadium och patologiskt tillstånd (Qin et al., 2007).
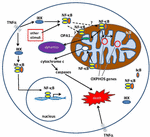
Figur 1. Vägar för nukleär faktor κ b (NF-kB) signalering i cytoplasman och mitokondrionen. NF-kB Tri-subunt-komplexet (t.ex. P65, P50, IkB – one möjlig kombination) finns i ett inaktivt tillstånd i cytoplasman. NF-kB-aktivering initieras när molekyler som TNFa binder till TNF-receptorer (olika typer finns)., Andra externa eller interna stimuli kan också aktivera NF-kB. Ett komplicerat signalöverföring processen börjar sedan när TNF-receptorer aktiveras; IkB kinas (IKK) är i slutändan ökar och leder till fosforylering av IkB, vilket resulterar i IkB ubiquitination och nedbrytning. När IkB bryts ned, översätts den återstående NF-kB dimer (t.ex. P65/P50 eller P50/P50 subenhet kombinationer är möjliga) till kärnan, där den binder till en DNA konsensus sekvens av målgener., Genom processer som inte är väl förstådda kan NF-kB-komplexet eller NF-kB-subenheterna också migrera till mitokondrionen, där bevis tyder på det / de upptar intermembranutrymmet. Väl inne i mitokondrierna antas NF-kB interagera med OXFOSGENER (mitokondriella mtDNA) som leder till uttryck av proteiner som är involverade i olika funktioner, inklusive mitokondriell dynamik och COX III-reglering (komponent i komplex IV)., Bevis tyder också på att NF-kB kan fungera som en omkopplare i mitokondrierna och kontrollera balansen mellan utnyttjandet av cytoplasmatisk glykolys och mitokondriell andning i normala celler och i cancer. Slutligen pekar data också på inneboende apoptotisk pathway stimulering, där NF-kB-aktivering i mitokondrierna leder till cytokrom C-frisättning, vilket utlöser caspaskaskader och programmerad celldöd.,
organisatoriskt är NF-kB en rel-familj transkriptionsfaktor och är associerad med fem gener, NF-KB1, NF-kB2, RELA, RELB och REL (Chen och Greene, 2004); dessa gener kodar flera proteiner, NF-kB1, NF-kB2, RelA, RelB respektive C-Rel, där två av dessa proteiner är stora prekursorproteiner som kallas P105 och P100 som genomgår proteolys att bli P50 och P52, respektive. Dessa proteiner innehåller REL-homologidomäner (RHD) vid deras amino-terminal region; RHD-regionen består av 2 separata men angränsande domäner., Sekvensen som är mest avlägsen från karboxy-terminalområdet gör det möjligt för proteinet att binda till DNA. En mer inre sekvens tillåter rel-familjeproteinerna att dimerisera (homo – eller heterodimers) för undertryckande av uttryck via bindningen av deras motsvarande familj av hämmare, IkB-proteinerna (Chen och Greene, 2004). Den senare sekvensen innefattar den nukleära lokaliseringssekvensen (NLS) som blir omaskerad när IkB är obundet genom nedbrytning. LANTMÄTERIVERKET har till uppgift att vägleda eller märkning aktiva proteiner för import till cellkärnan (Chen och Greene, 2004; Karin et al., 2004; Barger et al.,, 2005).
tre av dessa proteiner (RelA, RelB och C-REL) kodar också en transactivering domain (TADs) i deras karboxy-terminal region. TADs tillåter dessa proteiner att interagera med den basala transkriptionsapparaten, känd som Tata-bindningsproteinet (TBP), transkriptionsfaktor IIB, liksom P300 och cAMP response element (CREB) bindande protein (CBP) transkriptionella medaktivatorer (Chen och Greene, 2004)., Endast dessa tre proteiner kan inducera transkription av deras DNA-kodande regioner medan de andra proteinerna, P50 och P52-homodimererna, kan uppta DNA-bindningsställena utan att initiera transkription. Med tanke på detta fungerar de senare 2 homodimererna av P50 och p52 som transkriptionella undertryckare (Chen och Greene, 2004).
p105 och p100 homodimers ockupera DNA-bindande webbplatser därmed blockerar transkription via transkriptionsfaktorer som har TADs (Barger et al., 2005). En tredje form av transkriptionellt förtryck beror på IkB-proteiner., Dessa proteiner har flera ankyrin upprepningar som deras kärndomän och funktion genom att binda till RHD som maskerar NLS (Karin et al., 2004). Utan en aktiv NLS är NF-kB-proteinerna begränsade till cytoplasman och kan inte migrera in i kärnan och därför blockeras transkriptionen.
NF-kB finns i mitokondrierna
2001, en studie av Bottero et al. (2001) fann IkBa och NF-kB p65 subenheten i subcellulär fraktioner och renat mitokondrier från Jurkat celler. Jurkat-celler är en odödlig celllinje av humana t-lymfocytceller som används för att studera leukemi., I Botteros studie bestämdes att IkBa och NF-kB p65 lokaliserades i mitokondriellt intermembranutrymme. Det mitokondriella intermembranutrymmet är det utrymme som finns mellan det inre mitokondriella membranet (IMM) och det yttre mitokondriella membranet (OMM).
Därefter Cogswell et al. (2003) visade också att NF-kB-subenheter, p50 och p65, och IkBa, hittades i mitokondrierna. För att bestämma detta användes flera metoder för att tillhandahålla bevis, inklusive elektronmikroskopi av sektioner av u937 celler., U937 celler isolerades först från lymfom hos en medelålders manlig patient för att studera beteende och differentiering av monocyter. Här Cogswell et al. (2003) kunde visualisera NF-kB P50 och P65 subenheter och IkBa i mitokondriens inre matris. Råttleverceller undersöktes också i denna studie och p50-subenheten och IkBa-subenheten identifierades också. Dessutom stimulerades u937 celler för 1 h med TNFa, en känd utlösare av NF-kB-signalbanan., I detta experiment fann Western blot-analyser i mitokondriella och cytoplasmiska fraktioner att TNFa-behandling orsakade en förlust av IkBa i både mitokondriella och cytoplasmiska avdelningar med 30 min efter behandling vilket tyder på att IkBa försämrades. EMSA analys, en in vitro-analys som identifierar NF-kB aktivering och icke-specifik bindning till DNA-sekvenser, utfördes även på protein som tas från kärnkraft extrakt från mitokondrier isolerade från U937 celler stimuleras med TNFa., Här bestämde de TNFa-signalering ledde till ökad DNA-bindningsaktivitet av NF-kB p50, i protein taget från mitokondrier.
andra studier har också upptäckt NF-kB i mitokondrierna. Dessa inkluderar studier (Guseva et al., 2004; Zamora et al., 2004) i humana fibroblast HT1080 cellinjer, Human prostata LNCaP och PC3 cellinjer och HeLa celler. I LNCaP celler mitokondrier NF-kB p50 och p65 subenheter hittades bunden till mitokondrie-DNA (mtDNA)., Sammantaget visar dessa studier bevis för NF-kB-signalering i mitokondrierna och att NF-kB reglerar mitokondriellt mRNA-uttryck (se avsnittet NF-kB och mitokondriellt genuttryck nedan).
NF-kB-Kontroller Mitokondrie Dynamics
Det finns flera proteiner som är inblandade i dynamiken (fission och fusion) och morfologi av mitokondrier (Karbowski och Youle, 2003; Olichon et al., 2006; Brooks och Dong, 2007; Song et al., 2008; Autret och Martin, 2010; Silva m.fl., 2013; Sinha och Manoj, 2019). En av dessa är optisk atrofi 1 protein (OPA1) (Olichon et al.,, 2006; Garcia et al., 2018; Lee och Yoon, 2018). Studier har föreslagit att OPA1 är en regulator av mitokondriernas inre membran fusion och också mitokondrie cristae ombyggnad (Cipolat et al., 2006). Nyligen LaForge et al. (2016) visade att frånvaron av IKKa hade en inverkan på opa1-uttrycket i mitokondrierna och på mitokondriell morfologi.
överraskande, i en nyligen genomförd studie av Nan et al. (2017), TNFa receptor 2 (TNFR2) stimulering befanns främja mitokondriell fusion via NF-kB-beroende aktivering av opa1 uttryck i hjärt myocyter., Viktigt är att tnfr2-aktivering i denna studie skyddade hjärtmyocyter mot stress genom att uppreglera opa1-uttryck. Genom att administrera låga koncentrationer av exogent TNFa (0, 5 ng/mL) föreföll ischemi-reperfusion öka cellöverlevnaden, medan högre koncentrationer (10-20 ng/mL) ledde till toxiska effekter i celler.
NF-kB och apoptos i mitokondrierna
mitokondriernas roll i programmerad celldöd, eller apoptos har varit känd under ganska lång tid (Green And Reed, 1998; Wang och Chen, 2015)., Den viktigaste rollen för mitokondrierna är generationen av ATP; den näst viktigaste funktionen för mitokondrier är dock förmodligen att kontrollera celldöd. Hur gör mitokondrionen detta? Om mitokondrionen misslyckas med att utlösa celldöd, är cancer ofta konsekvensen. Så, för att reglera celldöd, integrerar mitokondrier signaler från en mängd olika källor, som är kända som inneboende vägar för apoptos. Komponenter av NF-kB-aktivitet verkar vara en av dessa signaler, även om TNFa, en aktivator av NF-kB, är en del av en extrinsisk väg för apoptos., Extrinsala vägar (dödreceptormedierade) initieras utanför cellen, medan inneboende vägar av apoptos medieras och utlöses i mitokondrier.
i en nyligen genomförd studie av Pazarentzos et al. (2014) visade sig IkBa utöva Pro-apoptotisk aktivitet eftersom den hämmade den anti-apoptotiska NF-kB. I de flesta celler leder aktiveringen av NF-kB till nedströms målgenuttryck som utlöser celldödsresistens (Luo et al., 2005). I denna studie visades att en ny apoptosfunktion berodde på IkBa, subenheten som hämmar NF-KBS aktivering. Pazarentzos et al., (2014) fann att IkBa lokaliserar till OMM där den interagerar med en spänningsberoende anionkanal (VDAC) och mitokondriell hexokinas II (HKII) för att stabilisera detta komplex och förhindra Bax-medierad cytokrom C-frisättning för apoptos. Bax är medlem i Bcl-2-familjen av proteiner, som har visat sig vara regulatorer för programmerad celldöd (Karbowski et al., 2006).
andra studier har också antytt NF-KBS roll i mer direkt reglering av apoptos i mitokondrionen. I en studie av Liu et al., (2004), hämning av NF-kB ensam i makrofager resulterade i frisättning av cytokrom c. minns att cytokrom C är ansvarig för att stänga elektroner från komplex III till komplex IV och att frisättningen av cytokrom C i cytoplasman, en aktivator av caspaser, är ett viktigt steg för att utlösa apoptos.
NF-kB och mitokondriell andning
nukleär faktor kappa B har visats i många studier för att främja tumorigenes. Hur detta inträffar var inte exakt klart. I en banbrytande studie av Mauro et al., (2011), NF-kB befanns uppreglera mitokondriell andning i kolonkarcinomceller. Här fastställde de att denna funktion av NF-kB undertrycker Warburg-effekten. Minns att Warburg effekt (Vander Heiden et al., 2009) beskriver observationen att cancerceller tenderar att gynna metabolism genom glykolys snarare än genom den effektivare oxidativa fosforyleringsvägen. Så i denna studie bestämde författarna att NF-kB organiserar nätverk av energimetabolism genom att kontrollera balansen mellan glykolysutnyttjande och mitokondriell andning., Intressant fann de en roll för NF-kB i metabolisk anpassning i normala celler och i cancer. Deras resultat tyder vidare på att undertryckande av mitokondriell metabolism i etablerade cancerceller genom hämning av NF-kB och metformin minskar tumörgenesen.
NF-kB och mitokondriellt genuttryck
nukleär faktor kappa B är en känd regulator av genuttryck – både negativt och positivt (Mattson et al., 2000). Men hur NF-kB reglerar eller påverkar kärnkodade mitokondriella genuttryck är mindre förstådd., Mänskliga mtDNA har 37 gener som kodar för 13 polypeptider. Det har visat sig att mtDNA-gener kodar för många av underenheter av alla 5 komplex av elektrontransportkedjan (ETC), 2 rRNAs, och 22 tRNAs. Om än, de flesta ETC subenheter kodas av nukleärt DNA, som kan påverkas av NF-kB aktivitet (Calvo et al., 2016).
det har till exempel hävdats (Cogswell et al., 2003) att NF-kB-vägen kan negativt reglera mitokondriellt genuttryck associerat med COX III-subenheten., COX III-subenheten kodas av mtDNA och är en komponent i komplex IV i mitokondriell etc. Den fungerar som en katalytisk subenhet i komplex IV, vilket är komplexet associerat med mitokondriell syreförbrukning. I en studie av Cogswell et al. (2003), modulering av NF-kB aktivering resulterade i förlust av uttryck för både COX III och cytokrom b mRNA. Andra studier stöder en roll för NF-kB reglera ytterligare mitokondriella gener, till exempel COX jag, och Cytb (Psarra och Sekeris, 2008, 2009; Barshad et al., 2018b)., Dessutom minskade NF-kB P65-subenheten nivåer av mtDNA-kodad CytB mRNA, eventuellt genom bindning till d-slingan i humana celler i frånvaro av p53 (Johnson et al., 2011). Sammantaget föreslår dessa resultat att NF-kB-signalering kan påverka den enzymatiska aktiviteten hos respiratoriska ETC-komplex.
NF-kB medierar Aß-inducerad dysfunktion i mitokondrierna
Alzheimers sjukdom (AD) är associerad med uppbyggnaden av Aß-plack och/eller utseendet av neurofibrillära tangles (NFTs) i vissa hjärnregioner (Duyckaerts et al., 2009)., Emellertid, kontroverser finns kring om Aß är ett orsakssamband av AD eller om Aß är helt enkelt korrelerad med åldrande. Ackumulerande bevis (Aliev et al., 2009; Correia m.fl., 2012; Cadonic et al., 2016; Cardoso et al., Och med 2017. Djordjevic et al., 2017) pekar också på förändringar i hjärnmetabolism som drivs av mitokondriell dysfunktion som en process som är central för många åldersrelaterade neurodegenerativa störningar, inklusive AD. Genom att lägga till detta bevis finns det också försämringar i enzymatisk aktivitet hos proteinkomplexen i ETC och förändringar i antioxidant enzymatisk aktivitet (Kolosova et al.,, 2017) i annons. I synnerhet har komplex IV-aktivitet visat sig påverkas negativt i AD (Mutisya et al., 1994).
i en nyligen genomförd studie av Shi et al. (2014), det konstaterades att Aß nedsatt mitokondriell funktion via NF-kB-signalering. Dessutom Shi et al. (2014) visade här att Aß minskat uttryck av COX III-enhet via en NF-kB väg., Allt för att eliminera möjligheten att IkBa var fosforyleras av Aß i cytoplasman (och sedan transporteras in i mitokondrierna), isolerade mitokondrier inkuberades med Aß i närvaron (eller frånvaron) av en NF-kB-blockerare, nämligen BAY11-7082. Här fann de Aß inducerad fosforylering och nedbrytning av IkBa i isolerade mitokondrier.
dessa fynd har också viktiga konsekvenser för AD-behandling, vilket framgår av nyligen genomförda studier av Snow et al. (2018) och som visas i andra relaterade studier (Djordjevic et al., Och med 2017. Adlimoghaddam et al.,, 2019) som föreslår inriktning av NF-kB-signalering i mitokondrier kan ha terapeutiskt värde. Till exempel i Snow et al.’s studie, kreatin – ett känt modulator för mitokondriell funktion (Tarnopolsky och Beal, 2001), har visat sig öka och positivt förändra protein nivåerna av CaMKII, PSD-95, och Komplex 1 underenheterna i kreatin matade möss, medan NF-kB hämmande IkB-underenheten minskat. För ytterligare läsning om kreatins potentiella terapeutiska effekt på mitokondriell funktion och i mitokondriella störningar eller andra neurologiska störningar, se studier och recensioner av Matthews et al., (1998), Klivenyi et al. (1999), Tarnopolsky och Beal (2001), Hersch et al. (2006), Rodriguez et al. (2007) och Beal (2011).
NF-KBS roll i Inflammation och mitokondriell Metabolism
ökande data (Lamas et al., 2003; Mauro m.fl., 2011; Moretti et al., 2012) föreslår att NF-kB-signalering, som är en mediator av inflammatoriska processer, fungerar också som en regulator och integrator med energimetabolism. I en studie av Zhong et al. (2016), NF-kB visades begränsa inflammasomaktivering via eliminering av skadade mitokondrier., Överraskande, NF-kB verkade både prime NLRP-3 inflammasome för aktivering och även hindrat en överdriven inflammation och återhållsam NLRP-3 inflammasome aktivering, även om mekanismen för återhållsamhet var dåligt definierade. Här spekulerades det att förutom att NF-kB är en aktivator av inflammatoriska gener fungerade det också i denna studie genom att begränsa NLRP3 inflammasomaktivering och IL-1β-produktion. Dessutom konstaterades det att p62 induktion var ansvarig för den inflammasomhämmande aktiviteten av NF-kB., Det verkar som NF-kB kan hålla tillbaka sin egen inflammation i makrofager genom att främja p62 medierad avlägsnande av skadade mitokondrier (mitophagy) efter makrofager interagera med olika NLRP3 inflammasome aktivatorer.
slutsats
För över 10 år sedan upptäcktes NF-kB i mitokondrierna. Överraskande, för en så viktig transkriptionsfaktor har små framsteg gjorts när det gäller att avslöja specifika roller för NF-kB som påverkar mitokondrionen., Vissa studier, som beskrivits ovan, ger bevis för NF-kB i mitokondriell dynamik, apoptos, andningskontroll, genuttryck och sjukdomsmekanismer (Figur 1). Dubbelarbete av dessa resultat och övergripande validering är dock fortfarande nödvändigt av andra laboratorier. Några ytterligare insikt som kan härledas från det faktum att andra transkriptionsfaktorer som har effekter på nukleära gener, till exempel AP-1, p53, CREB, c-Myc, Wnt13, Dok-4, HMGA1, och c-Src-har också upptäckts i mitokondrierna (Psarra och Sekeris, 2008)., Intressant är att bindningsställen i mitokondriellt genom (homologa till deras bindningsställen i nukleärt DNA) för några av dessa faktorer har bestämts (Psarra och Sekeris, 2008) där roller för mitokondriell transkription och apoptos misstänks och visar några övergripande aktivitetsmönster. Till exempel kan ett argument göras att några av dessa faktorer (NF-kB, CREB och AP-1) binder till mitokondriella genom och för det mesta dämpar mitokondriellt genuttryck (Blumberg et al., 2014), samtidigt som de har stimulerande effekter på nukleär gen transkription., Det krävs dock klart mer arbete för att inte bara hitta exakta verksamhetsroller utan också för att avgöra om övergripande aktivitetsmönster verkligen existerar.
Efter att ha granskat denna litteratur blir det också uppenbart att NF-KBS roll i regleringen av mitokondriell andning har djupa konsekvenser och visar en nivå av komplexitet som inte tidigare uppskattats. Till exempel, Mauro et al. (2011) data fastställer en roll för NF-kB i metabolisk anpassning i normala celler och i cancer, och föreslår också konsekvenser för andra sjukdomstillstånd som AD., Dessutom, med tanke på att NF-kB kan begränsa sin egen inflammation som visas av Zhong et al. (2016) är inte bara förvånande, men exemplifierar vidare komplexiteten hos NF-kB-signalering i mitokondriell funktion.
i denna översyn undersöktes studier om NF-KBS roll i mitokondriell funktion, och det verkar som att forskningen på detta område ökar. Komplicerar resultaten är dock observationen att flera faktorer spelar liknande roller i mitokondriell funktion och så detaljerade studier som är specifika för varje faktor är nödvändiga., Sammanfattningsvis kan vi åter ställa frågan – Vad gör NF-kB i och till mitokondrionen? Det omedelbara och förkortade svaret skulle vara-mycket!
Författarbidrag
författaren skapade ämnet och skrev manuskriptet.
Finansieringen
Detta arbete är finansierat med medel från Canadian Institutes of Health Research (CIHR), Svensk Jordbruks-Partnerskap (CAP), St. Boniface Hospital Research Foundation, Alzheimers Society of Manitoba, Forskning Manitoba, Ärade Douglas och Patricia Everett, och Royal Canadian Egenskaper Begränsad donationsfond.,
intressekonflikt uttalande
författaren förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.
bekräftelser
författaren vill tacka Dr Grant Hatch för en översyn av manuskriptet.
Hayden, M. S., och Ghosh, S. (2004). Signalering till NF-kappaB. Gener Dev. 18, 2195–2224.
PubMed Abstract/Google Scholar
Wang, X. Och Chen, X. J. (2015)., Ett cytosoliskt nätverk som undertrycker mitokondriermedierad proteostatisk stress och celldöd. Natur 524, 481-484. doi: 10.1038/nature14859
PubMed Abstrakt | CrossRef Full Text | Google Scholar