Brønsted-Lowry Teori om Syror och Baser
Brønsted-Lowry teori av syra och baser tog Arrhenius definition ett steg längre, som ett ämne som inte längre behövs för att bestå av väte (H+) eller hydroxid (OH-) joner för att klassificeras som en syra eller bas. För exmapl, överväga följande kemiska ekvation:
\
- en Brønsted-Lowry syra är en proton (vätejon) givare.
- En Brønsted-Lowry bas är en proton (vätejon) acceptor.,
i denna teori är en syra ett ämne som kan frigöra en proton (som i Arrhenius-teorin) och en bas är ett ämne som kan acceptera en proton., Ett grundsalt, som Na+F-, genererar OH – joner i vatten genom att ta protoner från själva vattnet (för att göra HF):
\
- Syradissociation
\
- Syrajoniseringskonstant:
\}{}\]
- Basdissociation:
\
- basjoniseringskonstant
\}{}\]
bestämningen av ett ämne som en Brønsted-Lowery syra eller bas kan endast göras genom att observera reaktionen. I fallet med HOH är det en bas i det första fallet och en syra i det andra fallet.,
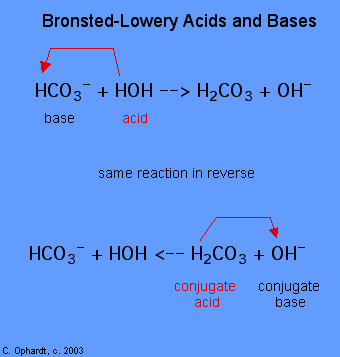
för att avgöra om ett ämne är en syra eller en bas, räkna hydrogenerna på varje ämne före och efter reaktionen. Om antalet hydrogener har minskat är ämnet syran (donerar vätejoner). Om antalet hydrogener har ökat är ämnet basen (accepterar vätejoner). Dessa definitioner tillämpas normalt på reaktanterna till vänster. Om reaktionen ses i omvänd ordning kan en ny syra och bas identifieras., Ämnena på höger sida av ekvationen kallas konjugatsyra och konjugatbas jämfört med dem till vänster. Observera också att den ursprungliga syran vänder sig i den konjugerade basen efter att reaktionen är över.
notera
syror är Protondonatorer och baser är Proton acceptorer
för att en reaktion ska vara i jämvikt måste en överföring av elektroner ske. Syran kommer att ge en elektron bort och basen kommer att få elektronen. Syror och baser som arbetar tillsammans på detta sätt kallas ett konjugat par bestående av konjugatsyror och konjugatbaser.,
\
a står för en sur förening och Z står för en grundläggande förening
- a donerar H för att bilda HZ+.
- Z accepterar H från en som bildar HZ+
- a-blir konjugatbas av HA och i omvänd reaktion accepterar den en H från HZ för att återskapa HA för att förbli i jämvikt
- HZ + blir en konjugatsyra av Z och i omvänd reaktion donerar den en H till A-återskapa Z för att förbli i jämvikt