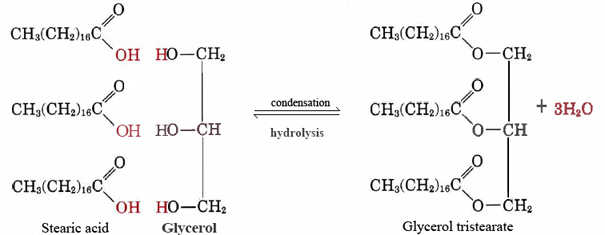
ett bra exempel på en nonpolar lipid är neutralt fett glyceroltristearat. Denna vanligaste form av animaliskt fett fungerar som ett lagerhus för energi och som isolering mot värmeförlust. På en molekylär nivå är den konstruerad av tre molekyler stearinsyra och en av glycerol:
 (1)
(1)
många nonpolära lipider kan tillverkas genom att kombinera olika långkedjiga syror med glycerol., Eftersom dessa syror ursprungligen härrör från fetter, kallas de kollektivt som fettsyror.
Observera att för varje stearinsyra eller annan fettsyramolekyl som kombinerar med en av OH-grupperna glycerol, ges en vattenmolekyl av, och så är reaktionen en kondensation. Det visar sig att många viktiga biologiska molekyler sätts ihop av kondensationsreaktioner under vilka vatten ges av. Baksidan av Eq. (1), där vatten reagerar med en stor molekyl och delar den i mindre bitar, kallas hydrolys., Genom att utföra hydrolys levande organismer kan bryta ner molekyler som tillverkas av andra arter. De enkla byggstenar som erhålls på detta sätt kan sedan rekombineras genom kondensationsreaktioner för att bilda strukturer som är lämpliga för deras nya värd.
i motsats till glyceroltristearat som finns hos djur innehåller vegetabiliska fetter många dubbelbindningar i sina långa kolvätekedjor. Denna polyunsaturation introducerar ”kinks” i kolvätekedjorna på grund av rotationsbarriären och de 120° vinklar som är förknippade med dubbelbindningarna., Följaktligen är det svårare att anpassa kedjorna sida vid sida (Se figur \(\PageIndex{1}\) ), och de omättade fetterna packar inte ihop lika lätt i en kristallgitter. Som var sant med alkaner, kedjelängd bestämmer också om ett fett är flytande eller fast, och där smältpunkten inträffar.
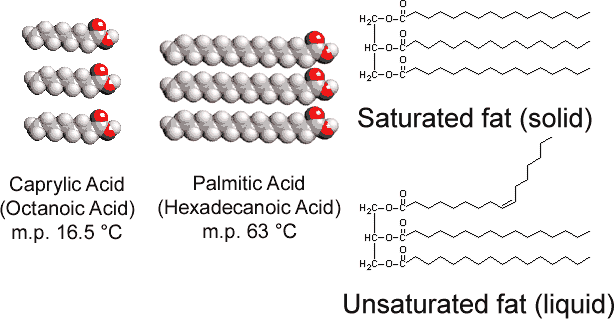
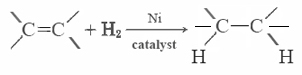
de flesta omättade fetter (som majsolja) är vätskor vid vanliga temperaturer, medan mättade fetter (som smör) är fasta ämnen. Vegetabiliska oljor kan omvandlas genom hydrogenering till föreningar som är fasta ämnen. Denna process innebär att H2 katalytiskt läggs till dubbelbindningarna:
hydrolys av fetter är viktigt vid tillverkningen av tvålar., Det kan påskyndas genom tillsats av en stark bas som NaOH eller KOH, i vilket fall reaktionen kallas förtvålning. Eftersom förtvålning kräver att reaktionsblandningens pH är hög, kommer fettsyran som produceras att dissociera till sin anjon. När glyceroltristearat förtvålas med NaOH bildas exempelvis natriumstearat, en relativt vattenlöslig substans och en vanlig tvål.
tvålarnas förmåga att rengöra fett och olja från smutsiga ytor är ett resultat av de dubbla hydrofoba hydrofila strukturerna hos deras molekyler., Stearatjonen består till exempel av en lång icke —polär kolvätekedja med en mycket polär– COO-grupp i ena änden.
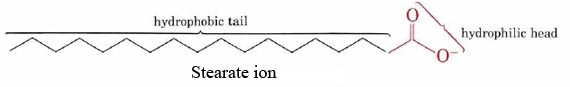
den hydrofoba kolvätekedjan försöker undvika kontakt med vattenhaltiga medier, medan den anjoniska gruppen lätt rymmer dipol attraktioner och vätebindningar av vattenmolekyler.
de två huvudsakliga sätten att de hydrofoba delarna av stearatjoner kan undvika vatten är att klustera ihop på ytan eller att lösa upp i en liten mängd olja eller fett (Se figur \(\PageIndex{2}\) ).,
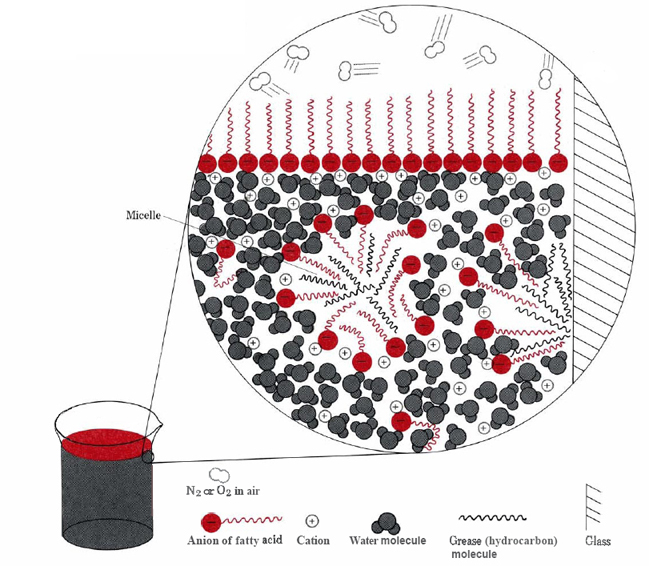
i det senare fallet kontaktar tvålmolekylernas hydrofila huvuden vattnet utanför fettet och bildar en struktur som kallas en micelle. Eftersom utsidorna av micellerna är negativt laddade, avstöter de varandra och förhindrar att fettdropparna rekombineras., Fettet suspenderas därför (emulgeras)i vattnet och kan lätt tvättas bort.
naturliga tvålar, såsom natriumstearat, gjordes ursprungligen i hemmet genom uppvärmning av animaliskt fett med träaska, som innehöll potash, K2CO3. Stora mängder produceras fortfarande industriellt, men i stor utsträckning har tvål ersatts av tvättmedel. Detta är en följd av det oönskade beteendet hos tvålar i hårt vatten. Kalcium, magnesium och andra hårda vattenkatjoner bildar olösliga föreningar i kombination med anjoner av fettsyror., Detta ger scummy fällningar och förhindrar tvålmolekylerna från emulgerande fett om inte ett stort överskott används.
tvättmedel som alkylbensensulfonater (ABS) och linjära alkylbensensulfonater (LAS) har strukturer som är mycket lik natriumstearat, förutom att den laddade gruppen i sina hydrofila huvuden är —SO3– fäst vid en bensenring. ABS-tvättmedlen har också metyl – (CH3) – grupper som förgrenar sina kolvätekedjor.,
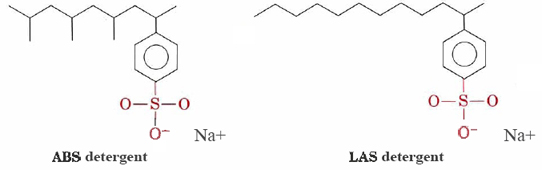
sådana molekyler fälls inte ut med hårda vattenkatjoner och är därför mer lämpade för maskintvätt av kläder. Las-tvättmedlen ersatte ABS under mitten av nittonhundratalet när det upptäcktes att de senare inte var biologiskt nedbrytbara. De orsakade floder och till och med kranvatten att bli täckta med tvättmedel och skum. Tydligen var enzymerna i mikroorganismer som hade utvecklats för att bryta ner de obearbetade kolvätekedjorna i naturliga fetter och fettsyror oförmögna att smälta de grenade kedjorna av ABS-molekyler., LAS-tvättmedel, även om de tillverkas av människor, efterliknar strukturerna för naturligt förekommande molekyler och är biologiskt nedbrytbara.