introduktion
elektroner har ingen fast position i atomer, föreningar och molekyler (se bilden nedan) men har sannolikheter att hittas i vissa utrymmen (orbitaler). Resonansformer illustrerar områden med högre sannolikheter (elektrondensiteter). Det är som att hålla hatten i höger eller vänster hand. Termen resonans tillämpas när det finns två eller flera möjligheter tillgängliga., Kemister använder Lewis diagram för att skildra struktur och bindning av kovalenta enheter, såsom molekyler och polyatomiska joner, hädanefter, molekyler. Lewis-diagrammet för många en molekyl överensstämmer emellertid inte med molekylens observerade egenskaper.
exempel \(\Pageindex{1}\): Nitratjon
nitratjonen, enligt sitt Lewis-diagram, har två typer av kväve-syrebindningar, en dubbelbindning och två enkelbindningar, vilket tyder på att en kväve-syrebindning i nitratjonen är kortare och starkare än var och en av de andra två., Lewis-strukturen innebär också, med avseende på formell laddning, att det finns två typer av syreatomer i nitratjonen, en formellt neutral och var och en av de andra två som bär en formell laddning av -1. Experimentellt har emellertid de tre kväve-syrebindningarna i nitratjonen samma bindningslängd och samma bindningsenergi, och de tre syreatomerna är oskiljbara. Lewis diagrammet misslyckas med att förklara strukturen och bindningen av nitratjonen tillfredsställande.
två ytterligare Lewis-diagram kan dras för nitratjon.,
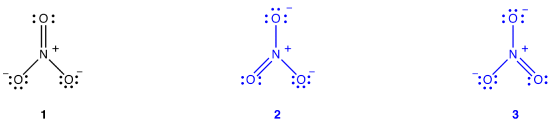
ingen av dem överensstämmer dock med nitratjonens observerade egenskaper och avbildar därför inte nitratjonen korrekt.
exempel \(\Pageindex{2}\): bensen
bensen, enligt sitt Lewis-diagram, har två typer av kol-kolbindningar, tre dubbelbindningar och tre enkla bindningar, vilket tyder på att var och en av tre kol-kolbindningar i bensen är kortare och starkare än var och en av de andra tre. Experimentellt har emellertid de sex kol-kolbindningarna i bensen samma bindningslängd och samma bindningsenergi., Lewis diagrammet misslyckas med att förklara strukturen och bindningen av bensen på ett tillfredsställande sätt.
ett attribut av molekyler av vilka det klassiska Lewis-diagrammet inte överensstämmer med de observerade egenskaperna är att andra giltiga Lewis-diagram kan genereras för dem. Ytterligare ett Lewis-diagram kan dras för bensen.

ingen av dem överensstämmer dock med bensenens observerade egenskaper och visar därför inte korrekt bensen.,
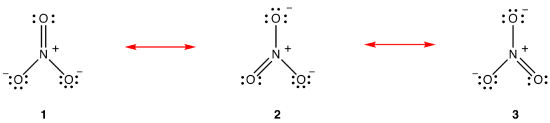
Resonansteori är ett försök att förklara strukturen hos en art, som nitratjon eller bensen, ingen Lewis diagram som överensstämmer med de observerade egenskaperna hos arten. Den största fördelen med resonansteori är att resonansteori, även om den bygger på rigorös matematisk analys, kan tillämpas framgångsrikt åberopande liten eller ingen matematik. Resonansteori förklaras nedan med hjälp av nitratjonen som exempel.
enligt resonansteori är nitratjonens struktur inte 1 eller 2 eller 3 utan genomsnittet av alla tre, viktade av stabilitet., Lewis diagram 1, 2 och 3 kallas resonansformer, resonansstrukturer eller resonans bidragsgivare av nitratjon. Nitratjonens struktur sägs vara en resonanshybrid eller, helt enkelt, hybrid av resonansformer 1, 2 och 3. När det är nödvändigt att visa nitratjonens struktur dras resonansformer 1, 2 och 3, förbundna med en dubbelhövdad pilar.,
nitratjonens tre resonansformer, 1, 2 och 3, är identiska, så de har samma stabilitet och bidrar därför lika till hybriden., Eftersom den exakta omfattningen av varje resonansform av nitratjon bidrar till hybriden är känd, kan bindningsordningen för varje kväve-syrebindning samt den formella laddningen på varje syreatom i hybriden lätt bestämmas:
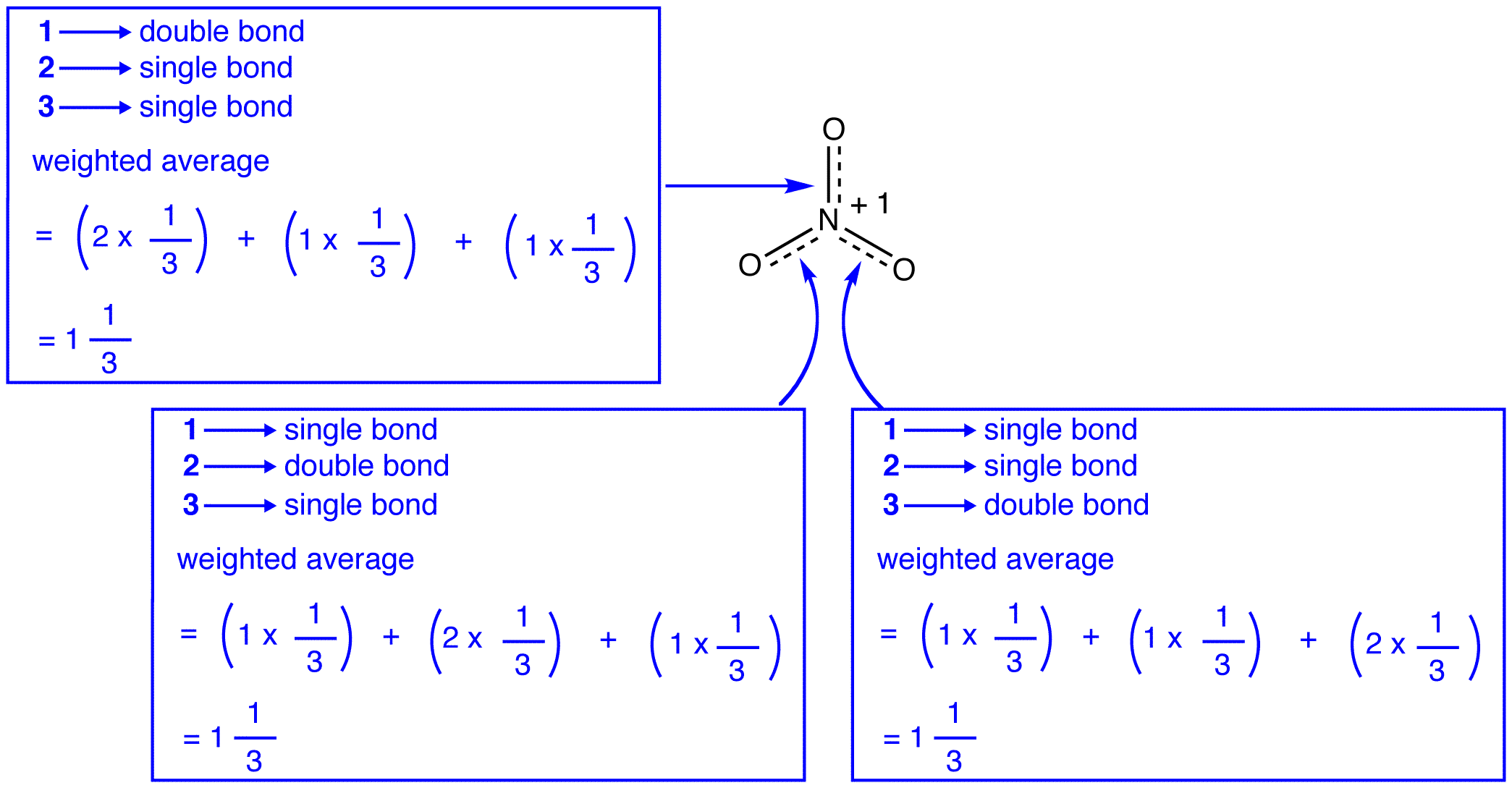
enligt resonansteori är varje bindning i nitratjon en och en tredjedel av en bindning, vilket överensstämmer med observationen att de tre bindningarna i nitratjon har samma bindningslängd och samma bindningsenergi.,
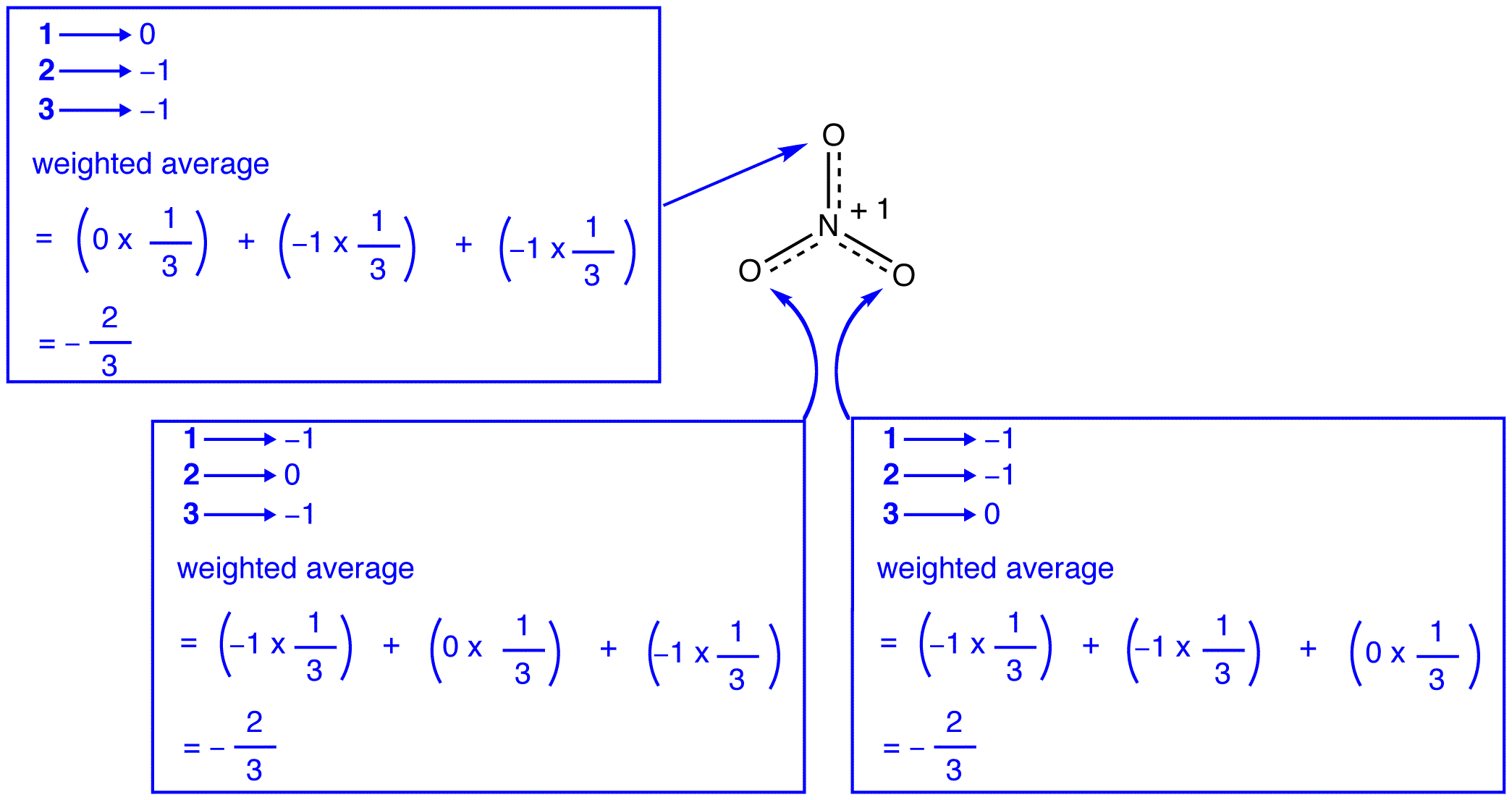
enligt resonansteori har varje syreatom i nitratjonen en formell laddning av -2 / 3, som i samband med det faktum att de tre kväve-syrebindningarna är identiska överensstämmer med observationen att de tre syreatomerna i nitratjonen är oskiljbara. I varje resonansform av nitratjonen finns det två\ (\pi\) elektroner, och de delas endast av två atomer. En elektron som delas endast av två atomer sägs vara lokaliserad., Således lokaliseras de två\ (\pi\) elektronerna i varje resonansform av nitratjonen. Nitratjonen, som representeras av hybriden, har två \(\pi\) elektroner:
- # elektroner i en \(\pi\) bond = 2
- # elektroner i en tredjedel av en \(\pi\) bond = 2/3
- # elektroner i tre av dem = 3 x (2/3) = 2
de två \(\pi\) elektronerna i nitratjonen delas av totalt fyra atomer, en kväveatom och tre syreatomer. En elektron som delas av mer än två atomer sägs vara delokaliserad. Således delokaliseras de två\ (\pi\) elektronerna i nitratjon., Delokalisering av\ (\pi\) elektroner i nitratjonen kräver att de fyra atomerna ligger på samma plan, vilket möjliggör lateral överlappning av p-orbitalerna på dem.,

om nitratjonens energi var det vägda genomsnittet av energierna i dess tre resonansformer, precis som nitratjonens struktur är det vägda genomsnittet av strukturerna i dess tre resonansformer, bör den vara lika med energin hos en av de tre identiska resonansformerna:

om hybridens energi var lika med en resonansform, med tanke på att alla kemiska enheter (elementära partiklar, atomer, molekyler etc.,) naturligtvis tenderar att vara i lägsta möjliga energitillstånd, det skulle inte finnas någon fördel för nitratjonen att existera som hybriden; det kan helt enkelt existera som en resonansform. Eftersom nitratjonen existerar som hybriden, inte som en resonansform, kan man dra slutsatsen att hybridens energi är lägre än för någon av resonansformerna.

enligt resonansteori är energin hos en molekyl lägre än den för den lägsta energiresonansformen., Eftersom nitratjonen har lägre energi och därför är stabilare än någon av dess resonansformer, sägs nitratjonen vara resonansstabiliserad.
vanliga missuppfattningar
det finns två missuppfattningar om resonansteori bland nybörjare, sannolikt på grund av bokstavlig tolkning av ordet resonans. De beskrivs nedan, med hjälp av nitratjonen som exempel.
missuppfattning 1: nitratjonen finns som resonansform 1 för ett ögonblick och ändras sedan antingen till resonansform 2 eller till resonansform 3, som interconvert eller återgår till 1.,

nitratjonstrukturen är inte 1 eller 2 eller 3 men hybriden och ändras inte med tiden om den inte genomgår en reaktion.
missuppfattning 2: i ett prov av nitratjoner finns vid ett givet tillfälle en tredjedel av jonerna som resonansform 1, en annan tredjedel som resonansform 2 och den återstående en tredjedel som resonansform 3.

i ett prov av nitratjoner har alla joner i ett givet ögonblick samma struktur, vilket är hybriden.,
mulor och noshörning
den klassiska analogi som används för att klargöra dessa två missuppfattningar är mule (Morrison, R. T.; Boyd, R. N. N. organisk kemi, femte upplagan; Allyn och Bacon: Boston, 1987, PG. 373). Biologiskt är en mule en hybrid av en häst och en åsna. Det betyder inte att en mule liknar en häst ett ögonblick och ändras sedan för att likna en åsna. Utseendet på en mule är en kombination av en hästs och en åsans utseende och förändras inte med tiden. Det betyder inte heller att i en besättning liknar vissa mulor en häst och de andra en åsna., I en besättning har alla mulor samma utseende, vilket är en kombination av en häst och en åsna. Svagheten i denna analogi är att hästar och åsnor existerar, medan resonansformer är strikt hypotetiska. En bättre analogi, citerad i Morrison och Boyd, är noshörningen. När man ser en noshörning kan man beskriva den som hybrid av en drake och en enhörning, två varelser som inte existerar.