Introducere
factorul Nuclear kappa B (NF-kB) este un factor vechi de transcriere a proteinelor (Salminen et al., 2008) și considerat un regulator al imunității înnăscute (Baltimore, 2009). Calea de semnalizare NF-kB leagă semnalele patogene și semnalele de pericol celular organizând astfel rezistența celulară la agenții patogeni invadatori., În fapt, o serie de studii au arătat NF-kB este un hub de rețea responsabil pentru biologice complexe de semnalizare (Albensi și Mattson, 2000; Kaltschmidt și Kaltschmidt, 2009; Karin, 2009). În acest scop, s-a presupus că NF-kB este un regulator principal al cascadelor biochimice conservate evolutiv (Mattson et al., 2000). Alți factori sunt, de asemenea, translocați în mitocondrii și sunt implicați în modularea expresiei (Barshad et al., 2018a), dar nu sunt punctul central al acestei revizuiri., Scopul acestei revizuiri este de a încerca să înțeleagă modul în care activitatea NF-kB contribuie la funcția mitocondrială. Se presupune că cititorul are deja o înțelegere a biologiei mitocondriale de bază. În caz de studiu în continuare, cititorul este menționat de mai multe excelent studii și recenzii pe mitocondriale structura și funcția (Hall, 1979; Fox, 1982; Roger și Silberman, 2002; Henze și Martin, 2003; Conradt, 2006; Ettema, 2016; Wang și Youle, 2016; Barshad et al., 2018b).,
activarea NF-kB
factorul Nuclear subunitățile kappa B, care cuprind complexul NF-kB, sunt exprimate atât în neuroni, cât și în glia. Complexul NF-kB există într-o stare inactivă în citoplasmă (Ghosh et al., 1998; Aggarwal și colab., 2004; Hayden și Ghosh, 2004) unde activarea NF-kB a fost bine descrisă (Li și Karin, 2000; Baud și Jacque, 2008; Israel, 2010). Când este stimulat de molecule precum TNFa sau alți factori de stres celulari, TNFa se leagă de receptorii TNF (Figura 1)., Această legare, prin mai multe etape intermediare, conduce la o interacțiune cu complexul IkB kinase (IKK), care duce apoi la fosforilarea IkB și, ulterior, are ca rezultat ubicuitatea și degradarea IkB. Odată degradat, dimerul NF-kB rămas (de exemplu, subunitățile p65/p50) se translocează în nucleu, unde se leagă de secvența de consens ADN a diferitelor gene țintă. Selectivitatea răspunsului NF-kB se bazează pe mai mulți factori (Sen și Smale, 2010), inclusiv compoziția dimerului, calendarul și tipul de celulă., Influența NF-kB asupra supraviețuirii celulare este, de asemenea, complexă și poate fi neuroprotector sau proinflamator, în funcție de tipul celulei, stadiul de dezvoltare și starea patologică (Qin et al., 2007).
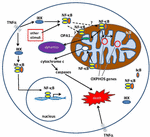
Figura 1. Căi pentru semnalizarea factorului nuclear κ b (NF-kB) în citoplasmă și mitocondrion. Complexul tri-subunt NF-kB (de exemplu, P65, p50, IkB – o combinație posibilă) există într-o stare inactivă în citoplasmă. Activarea NF-kB este inițiată atunci când molecule precum TNFa se leagă de receptorii TNF (există diferite tipuri)., Alți stimuli externi sau interni pot activa și NF-kB. Un proces complicat de transducție a semnalului începe apoi odată ce receptorii TNF sunt activați; kinaza IkB (IKK) este declanșată în cele din urmă și duce la fosforilarea IkB, ceea ce duce la Ubicitinarea și degradarea IkB. Odată ce IkB este degradat, dimerul NF-kB rămas (de exemplu, combinațiile de subunități p65/p50 sau p50/p50 sunt posibile) se translocează în nucleu, unde se leagă de o secvență de consens ADN a genelor țintă., Prin procese care nu sunt bine înțelese, complexul NF-kB sau subunitățile NF-kB pot migra și în mitocondrii, unde dovezile sugerează că ocupă spațiul intermembranar. Odată ajunși în mitocondrii, se crede că NF-kB interacționează cu genele OXPHOS (mtDNA mitocondrial) care conduc la exprimarea proteinelor implicate în diferite funcții, inclusiv dinamica mitocondrială și reglarea COX III (componenta complexului IV)., Dovezile sugerează, de asemenea, că NF-kB poate funcționa ca un comutator în mitocondrii și poate controla echilibrul dintre utilizarea glicolizei citoplasmatice și respirația mitocondrială în celulele normale și în cancer. În cele din urmă, datele indică, de asemenea, stimularea intrinsecă a căii apoptotice, unde activarea NF-kB în mitocondrii duce la eliberarea citocromului c, declanșând astfel cascade de caspază și moarte celulară programată.,
Organizatoric, NF-kB este un Rel de familie factor de transcriere și este asociat cu cinci gene, NF-kB1, NF-kB2, RELA, RELB, și REL (Chen și Greene, 2004); aceste gene codifica mai multe proteine, NF-kB1, NF-kB2, RelA, RelB, și c-Rel, respectiv, în cazul în care două dintre aceste proteine sunt mari precursor proteine cunoscut sub numele de p105 și p100 care sunt supuse proteolizei să devină p50 și p52, respectiv. Aceste proteine conțin domenii de REL-omologie (RHD) în regiunea lor amino-terminală; Regiunea RHD este compusă din 2 domenii separate, dar adiacente., Secvența cea mai îndepărtată de regiunea carboxi-terminală permite proteinei să se lege de ADN. O secvență mai interioară permite proteinelor familiei Rel să dimerizeze (homo – sau heterodimeri) pentru suprimarea expresiei prin legarea familiei lor corespunzătoare de inhibitori, proteinele IkB (Chen și Greene, 2004). Această din urmă secvență include secvența de localizare nucleară (NLS) care devine demascat atunci când IkB este nelegat de degradare. NLS are rolul de a ghida sau de a eticheta proteinele active pentru importul în nucleul celular (Chen și Greene, 2004; Karin et al., 2004; Barger și colab.,, 2005).trei dintre aceste proteine (RelA, RelB și c-REL) codifică, De asemenea, un domeniu de transactivare (TADs) în regiunea lor carboxi-terminală. TADs permit acestor proteine să interacționeze cu aparatul de transcripție bazală, cunoscut sub numele de proteina de legare TATA (TBP), factorul de transcripție IIB, precum și co-activatorii transcripționali P300 și elementul de răspuns cAMP (CREB) (CBP) (Chen și Greene, 2004)., Numai aceste trei proteine sunt capabile să inducă transcripția regiunilor lor de codificare a ADN-ului, în timp ce celelalte proteine, homodimerii p50 și p52, sunt capabili să ocupe locurile de legare a ADN-ului fără a iniția transcripția. Având în vedere acest lucru, cele 2 proteine homodimere ulterioare ale p50 și p52 acționează ca represoare transcripționale (Chen și Greene, 2004).homodimerii p105 și p100 ocupă situsurile de legare a ADN-ului, blocând astfel transcripția prin factori de transcripție care posedă TADs (Barger et al., 2005). O a treia formă de represiune transcripțională se datorează proteinelor IkB., Aceste proteine au mai multe repetări ankyrin ca domeniu și funcție de bază prin legarea la RHD care maschează NLS (Karin et al., 2004). Fără un NLS activ, proteinele NF-kB sunt limitate la citoplasmă și nu pot migra în nucleu și astfel transcrierea este blocată.
NF-kB se găsește în mitocondrii
în 2001, un studiu realizat de Bottero și colab. (2001) a găsit IkBa și subunitatea NF-kB p65 în fracțiunile subcelulare și mitocondriile purificate din celulele Jurkat. Celulele Jurkat sunt o linie celulară imortalizată a celulelor limfocite T umane care sunt utilizate pentru a studia leucemia., În Bottero de studiu, s-a stabilit că IkBa și NF-kB p65 au fost localizate în mitocondriale intermembrane spațiu. Spațiul intermembranar mitocondrial este spațiul care există între membrana mitocondrială interioară (IMM) și membrana mitocondrială exterioară (OMM).ulterior, Cogswell și colab. (2003) a arătat, de asemenea, că subunitățile NF-kB, p50 și p65 și IkBa, au fost găsite în mitocondrii. Pentru a determina acest lucru, au fost utilizate mai multe metode pentru a furniza dovezi, inclusiv microscopia electronică a secțiunilor celulelor U937., Celulele U937 au fost izolate mai întâi de limfomul unui pacient de sex masculin de vârstă mijlocie pentru a studia comportamentul și diferențierea monocitelor. Aici Cogswell și colab. (2003) a fost capabil să vizualizeze subunitățile NF-kB p50 și p65 și IkBa în matricea interioară a mitocondriilor. Celulele hepatice de șobolan au fost, de asemenea, examinate în acest studiu și au fost identificate și subunitatea p50 și subunitatea IkBa. În plus, celulele U937 au fost stimulate timp de 1 h cu TNFa, un declanșator cunoscut al căii de semnalizare NF-kB., În acest experiment, Western blot analize în mitocondriale și citoplasmatice fracțiuni a constatat că TNFa tratamentul a cauzat o pierdere de IkBa în ambele mitocondriale și citoplasmatice compartimente de 30 min după tratament, sugerând că IkBa a fost degradat. Analiza EMSA, un test in vitro care detectează activarea NF-kB și legarea nespecifică la secvențele ADN, a fost, de asemenea, efectuată pe proteine prelevate din extracte nucleare din mitocondriile izolate din celulele U937 stimulate cu TNFa., Aici au determinat semnalizarea TNFa a dus la creșterea activității de legare a ADN-ului NF-kB p50, în proteina preluată din mitocondrii.alte studii au detectat, de asemenea, NF-kB în mitocondrii. Acestea includ studii (Guseva et al., 2004; Zamora și colab., 2004) în linii celulare fibroblaste umane HT1080, linii celulare lncap și PC3 ale prostatei umane și celule HeLa. În celulele LNCaP, subunitățile mitocondriale NF-kB p50 și p65 au fost găsite legate de ADN mitocondrial (mtDNA)., Luate împreună, aceste studii arată dovezi pentru semnalizarea NF-kB în mitocondrii și că NF-kB reglează expresia ARNm mitocondrială (vezi secțiunea NF-kB și expresia genelor mitocondriale de mai jos).există mai multe proteine implicate în dinamica (fisiunea și fuziunea) și morfologia mitocondriilor (Karbowski și Youle, 2003; Olichon și colab., 2006; Brooks și Dong, 2007; Song și colab., 2008; Autret și Martin, 2010; Silva și colab., 2013; Sinha și Manoj, 2019). Una dintre acestea este proteina atrofie optică 1 (OPA1) (Olichon și colab.,, 2006; Garcia și colab., 2018; Lee și Yoon, 2018). Studiile au sugerat că OPA1 este un regulator de mitocondriale membrana interioară de fuziune și, de asemenea, mitocondriale cristae remodelare (Cipolat et al., 2006). Recent, Laforge și colab. (2016) a arătat că absența IKKa a avut un impact asupra expresiei OPA1 în mitocondrii și asupra morfologiei mitocondriale.în mod surprinzător, într-un studiu recent realizat de Nan și colab. (2017), s-a constatat că stimularea receptorului TNFa 2 (TNFR2) promovează fuziunea mitocondrială prin activarea dependentă de NF-kB a expresiei OPA1 în miocitele cardiace., Foarte important, activarea TNFR2 în acest studiu a protejat miocitele cardiace împotriva stresului prin reglarea expresiei OPA1. Prin administrarea unor concentrații scăzute de TNFa exogen (0,5 ng/mL) înainte de ischemie-reperfuzia a părut să sporească supraviețuirea celulară, în timp ce concentrațiile mai mari (10-20 ng/mL) au condus la efecte toxice în celule.rolul mitocondriilor în moartea celulară programată sau apoptoza este cunoscut de ceva timp (Green and Reed, 1998; Wang and Chen, 2015)., Cel mai important rol pentru mitocondrii este generarea de ATP; cu toate acestea, a doua funcție cea mai importantă pentru mitocondrii este probabil în controlul morții celulare. Cum face mitocondriul asta? Dacă mitocondriul eșuează la declanșarea morții celulare, cancerul este adesea consecința. Deci, pentru a regla moartea celulelor, mitocondriile integrează semnale dintr-o varietate de surse, cunoscute sub numele de Căi intrinseci de apoptoză. Componentele activității NF-kB par a fi unul dintre aceste semnale, deși TNFa, un activator al NF-kB, face parte dintr-o cale extrinsecă de apoptoză., Căile extrinseci (mediate de receptorul morții) sunt inițiate în afara celulei, în timp ce căile intrinseci ale apoptozei sunt mediate și declanșate în mitocondrii.într-un studiu recent realizat de Pazarentzos și colab. (2014), sa constatat că IkBa exercită o activitate pro-apoptotică, deoarece a inhibat NF-kB anti-apoptotic. În majoritatea celulelor, activarea NF-kB duce la expresia genei țintă în aval care declanșează rezistența la moartea celulelor (Luo et al., 2005). În acest studiu, sa demonstrat că o nouă funcție de apoptoză sa datorat IkBa, subunitatea care inhibă activarea NF-kB. Pazarentzos și colab., (2014) a constatat că IkBa localizează la OMM în cazul în care acesta interacționează cu o tensiune dependentă de anioni canal (VDAC) și mitocondriale hexochinază II (HKII) pentru a stabiliza acest complex și pentru a preveni Bax mediate de citocromul c, presă pentru apoptoză. Bax este un membru al familiei Bcl-2 de proteine, care s-au dovedit a fi regulatori ai morții celulare programate (Karbowski et al., 2006).alte studii au sugerat, de asemenea, rolul NF-kB în reglarea mai directă a apoptozei în mitocondrii. Într-un studiu realizat de Liu et al., (2004), inhibarea NF-kB singur în macrofage a dus la eliberarea citocromului c. Reamintim că citocromul c este responsabil pentru shuttling electroni din Complex III la Complexul IV și că eliberarea citocromului c in citoplasma, un activator de caspaze, este un pas cheie în declanșarea apoptozei.
NF-kB și respirația mitocondrială
factorul Nuclear kappa B a fost demonstrat în multe studii pentru a promova tumorigeneza. Cum se întâmplă acest lucru nu a fost exact clar. Într-un studiu revoluționar realizat de Mauro et al., (2011), s-a constatat că NF-kB reglează respirația mitocondrială în celulele carcinomului de colon. Aici au stabilit că această funcție A NF-kB suprimă efectul Warburg. Reamintim că efectul Warburg (Vander Heiden și colab., 2009) descrie observația că celulele canceroase tind să favorizeze metabolismul prin glicoliză, mai degrabă decât prin calea de fosforilare oxidativă mai eficientă. Deci, în acest studiu, autorii au stabilit că NF-kB organizează rețele de metabolism energetic prin controlul echilibrului dintre utilizarea glicolizei și respirația mitocondrială., Interesant este că au găsit un rol pentru NF-kB în adaptarea metabolică în celulele normale și în cancer. Rezultatele lor au sugerat în continuare că suprimarea metabolismului mitocondrial în celulele canceroase stabilite prin inhibarea NF-kB și metformin scade tumorigeneza.factorul Nuclear kappa B este un regulator cunoscut al expresiei genelor – atât negativ, cât și pozitiv (Mattson et al., 2000). Cu toate acestea, modul în care NF-kB reglează sau influențează expresia genei mitocondriale codificate nuclear este mai puțin înțeles., MtDNA uman posedă 37 de gene care codifică pentru 13 polipeptide. S-a demonstrat că genele mtDNA codifică multe dintre subunitățile tuturor celor 5 complexe ale lanțului de transport de electroni (ETC), 2 ARNr și 22 tRNAs. Deși majoritatea subunităților ETC sunt codificate prin ADN nuclear, care ar putea fi influențat de activitatea NF-kB (Calvo et al., 2016).
de exemplu, a fost revendicat (Cogswell et al., 2003) că calea NF-kB poate regla negativ expresia genei mitocondriale asociată cu subunitatea COX III., Subunitatea COX III este codificată de mtDNA și este o componentă a complexului IV în mitocondrial etc. Funcționează ca o subunitate catalitică în complexul IV, care este complexul asociat cu consumul de oxigen mitocondrial. Într-un studiu realizat de Cogswell et al. (2003), modularea activării NF-kB a dus la pierderea expresiei atât a ARNm COX III, cât și a citocromului B. Alte studii susțin rolul NF-kB, care reglementează suplimentar genele mitocondriale, cum ar fi COX eu, și Cytb (Psarra și Sekeris, 2008, 2009; Barshad et al., 2018b)., În plus, subunitatea NF-kB p65 a redus nivelurile de ARNm CITB codificat de mtDNA, posibil prin legarea la bucla D din celulele umane în absența p53 (Johnson et al., 2011). În general, aceste rezultate sugerează că semnalizarea NF-kB poate influența activitatea enzimatică a complexelor respiratorii etc.
NF-kB Mediază Aß Induse de Disfuncția în Mitocondrii
boala Alzheimer (AD) este asociat cu acumularea de Aß plăci și/sau apariția de încurcătura fibrelor (NFTs) în anumite regiuni ale creierului (Duyckaerts et al., 2009)., Cu toate acestea, există controverse în legătură cu faptul că Aß este un agent cauzator al AD sau dacă Aß este pur și simplu corelat cu îmbătrânirea. Acumularea dovezilor (Aliev et al., 2009; Correia și colab., 2012; Cadonic și colab., 2016; Cardoso și colab., 2017; Djordjevic și colab., 2017), de asemenea, indică acum modificări ale metabolismului creierului determinate de disfuncția mitocondrială ca proces central pentru multe tulburări neurodegenerative legate de vârstă, inclusiv AD. Adăugând la aceste dovezi, există, de asemenea, deficiențe în activitatea enzimatică a complexelor proteice ale ETC și modificări ale activității enzimatice antioxidante (Kolosova et al.,, 2017) în AD. În special, activitatea complexă IV sa dovedit a fi afectată negativ în AD (Mutisya et al., 1994).într-un studiu recent realizat de Shi și colab. (2014), sa constatat că Aß a afectat funcția mitocondrială prin semnalizarea NF-kB. Mai mult, Shi și colab. (2014) a arătat aici că Aß a scăzut expresia subunității COX III printr-o cale NF-kB., Important, pentru a elimina posibilitatea ca IkBa a fost fosforilat de Aß în citoplasmă (și apoi transportat în mitocondrii), izolat mitocondriile au fost incubate cu Aß în prezența (sau absența) NF-kB blocker, și anume BAY11-7082. Aici au găsit fosforilarea indusă de Aß și degradarea IkBa în mitocondriile izolate.aceste constatări au, de asemenea, implicații importante pentru tratamentul AD, așa cum au demonstrat studiile recente ale Snow et al. (2018) și așa cum s-a arătat în alte studii conexe (Djordjevic et al., 2017; Adlimoghaddam și colab.,, 2019) care sugerează direcționarea semnalizării NF-kB în mitocondrii poate avea valoare terapeutică. De exemplu, în Snow și colab.studiul, creatina-un modulator cunoscut al funcției mitocondriale (Tarnopolsky și Beal, 2001), sa dovedit a crește și a modifica pozitiv nivelurile de proteine ale CaMKII, PSD-95 și subunitățile complexe 1 la șoarecii hrăniți cu creatină, în timp ce subunitatea IkB inhibitoare NF-kB a fost scăzută. Pentru lecturi suplimentare despre efectul terapeutic potențial al creatinei asupra funcției mitocondriale și în tulburările mitocondriale sau alte tulburări neurologice, vezi studii și recenzii de Matthews et al., (1998), Klivenyi și colab. (1999), Tarnopolsky și Beal (2001), Hersch și colab. (2006), Rodriguez și colab. (2007) și Beal (2011).
rolul NF-kB în inflamație și metabolismul mitocondrial
creșterea datelor (Lamas et al ., 2003; Mauro și colab., 2011; Moretti și colab., 2012) sugerează că semnalizarea NF-kB, care este un mediator al proceselor inflamatorii, funcționează și ca regulator și integrator cu metabolismul energetic. Într-un studiu recent realizat de Zhong et al. (2016), s-a demonstrat că NF-kB restricționează activarea inflammasomelor prin eliminarea mitocondriilor deteriorate., În mod surprinzător, NF-kB au apărut atât prim NLRP-3 numită inflammasome pentru activare și, de asemenea, împiedicat excesivă inflamație și reținut NLRP-3 numită inflammasome de activare; deși mecanismul de reținere a fost slab definite. Aici s-a speculat că, pe lângă faptul că NF-kB este un activator al genelor inflamatorii, a funcționat și în acest studiu prin limitarea activării inflammasome NLRP3 și a producției de IL-1β. Mai mult, s-a constatat că inducția p62 a fost responsabilă pentru activitatea inhibitorie inflammasomală de către NF-kB., Se pare că NF-kB își poate restrânge propria inflamație în macrofage prin promovarea îndepărtării mediate de P62 a mitocondriilor deteriorate (mitofagie) după ce macrofagele interacționează cu diferiți activatori inflammasomi NLRP3.
concluzie
în urmă cu 10 ani, NF-kB a fost detectat în mitocondrii. În mod surprinzător, pentru un factor de transcripție atât de important, s-au înregistrat puține progrese în descoperirea rolurilor specifice pentru NF-kB care afectează mitocondriul., Unele studii, așa cum sunt descrise mai sus, oferă dovezi pentru NF-kB în dinamica mitocondrială, apoptoza, controlul respirator, expresia genelor și mecanismele bolii (Figura 1). Cu toate acestea, duplicarea acestor rezultate și validarea generală sunt încă necesare de către alte laboratoare. Unele perspectiva suplimentare pot fi obținute de la faptul că alți factori de transcriere a avea efecte pe gene nucleare, cum ar fi AP-1, p53, CREB, c-Myc, Wnt13, Dok-4, HMGA1, și c-Src, de asemenea, au fost detectate în mitocondrii (Psarra și Sekeris, 2008)., Interesant, site-uri de legare în genomul mitocondrial (omoloage de pe locurile lor de legare la ADN-ul nuclear) pentru unii dintre acești factori au fost determinate (Psarra și Sekeris, 2008), unde rolurile pentru mitocondriale transcriere și apoptoza sunt suspectați și de a arăta unele de ansamblu a modelelor de activitate. De exemplu, se poate argumenta că unii dintre acești factori (NF-kB, CREB și AP-1) se leagă de genomii mitocondriali și atenuează mai ales expresia genelor mitocondriale (Blumberg et al., 2014), având în același timp efecte stimulatoare asupra transcripției genei nucleare., Cu toate acestea, este nevoie de mai multă muncă pentru a găsi nu numai roluri precise de activitate, ci și pentru a determina dacă există cu adevărat modele generale de activitate.
după studierea acestei literaturi, devine evident că rolul NF-kB în reglarea respirației mitocondriale are implicații profunde și demonstrează un nivel de complexitate care nu a fost apreciat anterior. De exemplu, Mauro și colab. (2011) datele stabilesc un rol pentru NF-kB în adaptarea metabolică în celulele normale și în cancer și sugerează, de asemenea, consecințe pentru alte stări de boală, cum ar fi AD., Mai mult, având în vedere că NF-kB își poate restrânge propria inflamație, așa cum arată Zhong et al. (2016), nu numai că este surprinzător, dar exemplifică în continuare complexitatea semnalizării NF-kB în funcția mitocondrială.în această revizuire, au fost chestionate studii privind rolul NF-kB în funcția mitocondrială și se pare că cercetarea în acest domeniu este în creștere. Complicarea rezultatelor este totuși observația că mai mulți factori joacă roluri similare în funcția mitocondrială și sunt necesare studii detaliate specifice fiecărui factor., În concluzie, putem re-pune întrebarea – ce face NF-kB în și în mitocondrii? Răspunsul imediat și abreviat ar fi – mult!
contribuții ale autorului
autorul a creat subiectul și a scris manuscrisul.
de Finanțare
Această lucrare a fost susținută prin finanțare de la Canadian Institute de Cercetare în domeniul Sănătății (CIHR), Canadian Agricole Parteneriat (PAC), St. Boniface Spital Fundatia de Cercetare, Alzheimer Society of Manitoba, Cercetare Manitoba, Onorabilul Douglas și Patricia Everett, și Royal Canadian Properties Limited Fondul.,
Conflict de interese declarație
autorul declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
mulțumiri
autorul ar dori să-i mulțumesc Dr.Grant Hatch pentru o revizuire a manuscrisului.
Hayden, MS, și Ghosh, S. (2004). Semnalizez către NF-kappaB. Gene Dev. 18, 2195–2224.
PubMed Abstract | Google Scholar
Wang, X. și Chen, X. J. (2015)., O rețea citosolică care suprimă stresul proteostatic mediat de mitocondrii și moartea celulelor. Natură 524, 481-484. doi: 10.1038 / nature14859
PubMed Abstract / CrossRef Full Text / Google Scholar