Obiectivele de Învățare
- Defini coroziune
- Lista unele dintre metodele folosite pentru a preveni sau încetini coroziune
Coroziune este de obicei definită ca o degradare a metalelor din cauza unui proces electrochimic. Formarea ruginei pe fier, pătarea pe argint și patina albastru-verde care se dezvoltă pe cupru sunt toate exemple de coroziune., Costul total al coroziunii în Statele Unite este semnificativ, estimările depășind o jumătate de trilion de dolari pe an.poate cel mai cunoscut exemplu de coroziune este formarea ruginei pe fier. Fierul va rugini atunci când este expus la oxigen și apă. Principalele etape în ruginirea fierului par să implice următoarele (Figura 2). Odată expus în atmosferă, fierul se oxidează rapid.
electronii reduc oxigenul din aer în soluții acide.
ceea Ce noi numim rugina este hidratat de fier(III) oxid, care se formează atunci când de fier(II) ioni reacționează în continuare cu oxigen.,
numărul de molecule de apă este variabil, astfel încât acesta este reprezentat de x. Spre deosebire de patina de cupru, formarea de rugina nu creează un strat protector și atât de coroziune a fierului continuă ca rugina se exfoliază și expune proaspete de fier în atmosferă.
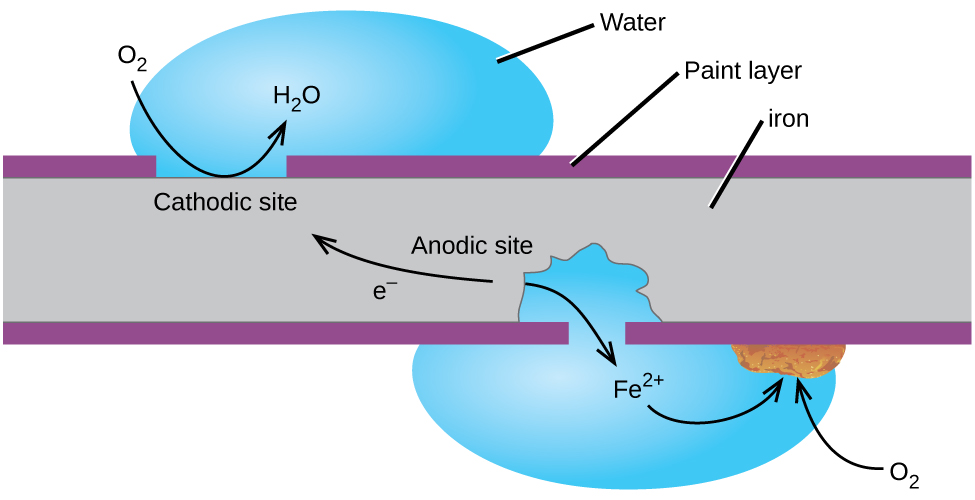
O modalitate de a păstra fier din inox este să-l păstrați pictat. Stratul de vopsea împiedică apa și oxigenul necesar pentru formarea ruginei să intre în contact cu fierul. Atâta timp cât vopseaua rămâne intactă, fierul este protejat de coroziune.,alte strategii includ alierea fierului cu alte metale. De exemplu, oțelul inoxidabil este în mare parte fier cu un pic de crom. Cromul tinde să se colecteze în apropierea suprafeței, unde formează un strat de oxid care protejează fierul.fierul zincat sau galvanizat folosește o strategie diferită. Zincul este mai ușor oxidat decât fierul, deoarece zincul are un potențial de reducere mai mic. Deoarece zincul are un potențial de reducere mai mic, este un metal mai activ. Astfel, chiar dacă stratul de zinc este zgâriat, zincul se va oxida în continuare înaintea fierului., Acest lucru sugerează că această abordare ar trebui să funcționeze cu alte metale active.un alt mod important de a proteja metalul este de a face catodul într-o celulă galvanică. Aceasta este o protecție catodică și poate fi utilizată pentru alte metale decât fierul. De exemplu, ruginirea rezervoarelor și țevilor subterane de depozitare a fierului poate fi prevenită sau redusă considerabil prin conectarea acestora la un metal mai activ, cum ar fi zincul sau Magneziul (Figura 3). Acest lucru este, de asemenea, utilizat pentru a proteja piesele metalice din încălzitoarele de apă., Metalele mai active (potențial de reducere mai mic) sunt numite anozi sacrificiali, deoarece, pe măsură ce se consumă, corodează (oxidează) la anod. Metalul protejat servește drept catod și astfel nu se oxidează (corodează). Atunci când anozi sunt monitorizate în mod corespunzător și înlocuite periodic, durata de viață utilă a rezervorului de stocare de fier poate fi extins foarte mult.
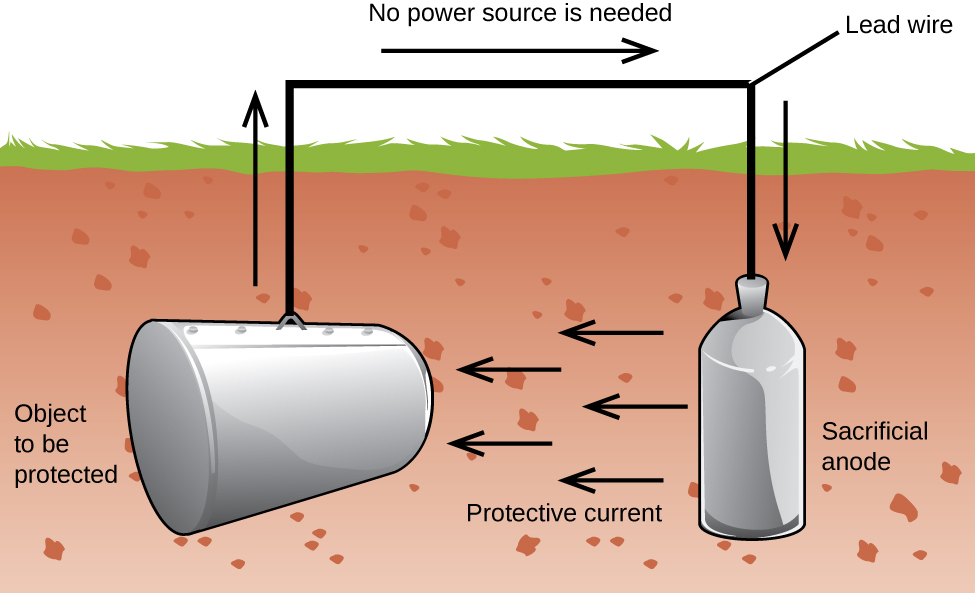
Coroziune este degradarea unui metal cauzate de un proces electrochimic. Sume mari de bani sunt cheltuite în fiecare an pentru repararea efectelor sau prevenirea coroziunii. Unele metale, cum ar fi aluminiu și cupru, produc un strat protector atunci când corodează în aer., Stratul subțire care se formează pe suprafața metalului împiedică oxigenul să intre în contact cu mai mulți atomi de metal și astfel „protejează” metalul rămas de coroziunea ulterioară. Fierul corodează (formează rugina) atunci când este expus la apă și oxigen. Rugina care se formează pe fierul metalic se desprinde, expunând metale proaspete, care corodează și ele. O modalitate de a preveni sau încetini coroziunea este prin acoperirea metalului. Acoperirea împiedică apa și oxigenul să intre în contact cu metalul. Vopseaua sau alte acoperiri vor încetini coroziunea, dar nu sunt eficiente odată zgâriate., Fierul zincat sau galvanizat exploatează faptul că zincul este mai probabil să se oxideze decât fierul. Atâta timp cât acoperirea rămâne, chiar dacă este zgâriată, zincul se va oxida înaintea fierului. O altă metodă de protecție a metalelor este protecția catodică. În această metodă, un metal ușor oxidat și ieftin, adesea zinc sau magneziu (anodul sacrificial), este conectat electric la metalul care trebuie protejat. Metalul mai activ este anodul sacrificial și este anodul într-o celulă galvanică. Metalul „protejat” este catodul și rămâne neoxidat., Un avantaj al protecției catodice este că anodul sacrificial poate fi monitorizat și înlocuit dacă este necesar.,
Glosar
metoda de protecție catodică de protejare a metalului prin utilizarea unui anod de sacrificiu și de a face în mod eficient metalul care are nevoie de protejarea catod, prevenind astfel oxidarea degradarea coroziunii metalului printr-un proces electrochimic metoda de fier galvanizat pentru protejarea fierului prin acoperirea acestuia cu zinc, care va oxida înainte de fier; zincat anod de sacrificiu de fier din capitolul exerciții
2., Mg și Zn
4. Ambele exemple implică protecție catodică. Anodul (sacrificial) este metalul care corodează (oxidează sau reacționează). În cazul fierului (-0.447 V) și zincului (-0.7618 V), zincul are un potențial de reducere standard mai negativ și astfel servește ca anod. În cazul fierului și cuprului (0,34 V), fierul are potențialul de reducere standard mai mic și astfel corodează (servește ca anod).
6., În timp ce potențialul de reducere a litiului ar face capabil să protejeze celelalte metale, acest potențial ridicat indică, de asemenea, cât de reactiv este litiul; ar avea o reacție spontană cu majoritatea substanțelor. Aceasta înseamnă că litiul ar reacționa rapid cu alte substanțe, chiar și cu cele care nu ar oxida metalul pe care încearcă să îl protejeze. Reactivitatea ca aceasta înseamnă că anodul sacrificial ar fi epuizat rapid și trebuie înlocuit frecvent. (Motiv suplimentar opțional: pericol de incendiu în prezența apei.)