Brønsted-Lowry Teoria Acizilor și Bazelor
Brønsted-Lowry teoria de acizi și baze luat Arrhenius definiție un pas mai departe, ca o substanță nu mai este necesar să fie compus din hidrogen (H+) sau hidroxid (OH-) ionii în scopul de a fi clasificate ca un acid sau de bază. Pentru exmapl, ia în considerare următoarea ecuație chimică:
\
- Un Brønsted-Lowry acid este un protoni (ioni de hidrogen) donator.
- o bază Brønsted-Lowry este un acceptor de protoni (ioni de hidrogen).,în această teorie, un acid este o substanță care poate elibera un proton (ca în teoria Arrhenius) și o bază este o substanță care poate accepta un proton., O bază de sare, cum ar fi Na+F-, generează ioni OH – în apă prin luarea protonii din apă în sine (pentru a face HF):
\
- Acid disociere
\
- Acid Ionizare Constantă:
\}{}\]
- Baza de disociere:
\
- Baza de Ionizare Constantă
\}{}\]
determinarea unei substanțe ca Brønsted-Lowery de acid sau de bază se poate face numai cu respectarea reacție. În cazul HOH este o bază în primul caz și un acid în al doilea caz.,
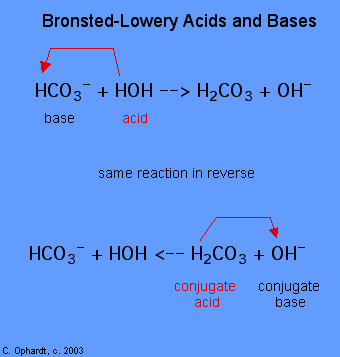
pentru a determina dacă o substanță este un acid sau o bază, numărați hidrogenii pe fiecare substanță înainte și după reacție. Dacă numărul de hidrogeni a scăzut, acea substanță este acidul (donează ioni de hidrogen). Dacă numărul de hidrogeni a crescut, acea substanță este baza (acceptă ioni de hidrogen). Aceste definiții se aplică în mod normal reactanților din stânga. Dacă reacția este văzută în sens invers, se poate identifica un nou acid și o bază., Substanțele din partea dreaptă a ecuației se numesc acid conjugat și bază conjugată în comparație cu cele din stânga. De asemenea, rețineți că acidul original se transformă în baza conjugată după terminarea reacției.
notă
acizii sunt donatori de protoni și bazele sunt acceptori de protoni
pentru ca o reacție să fie în echilibru, trebuie să aibă loc un transfer de electroni. Acidul va da un electron departe și baza va primi electronul. Acizii și bazele care lucrează împreună în acest mod sunt numite o pereche conjugată formată din acizi conjugați și baze conjugate.,
\
A reprezintă un compus acid și Z reprezintă un compus bazic
- a donează H pentru a forma HZ+.
- Z acceptă H de la A care formează HZ+
- A – devine baza conjugată a HA și în reacția inversă acceptă un H de la HZ pentru a recrea HA pentru a rămâne în echilibru
- HZ+ devine un acid conjugat al Z și în reacția inversă donează un H la a-recrearea Z pentru a rămâne în echilibru