Relația dintre Presiune și Volum: Legea lui Boyle
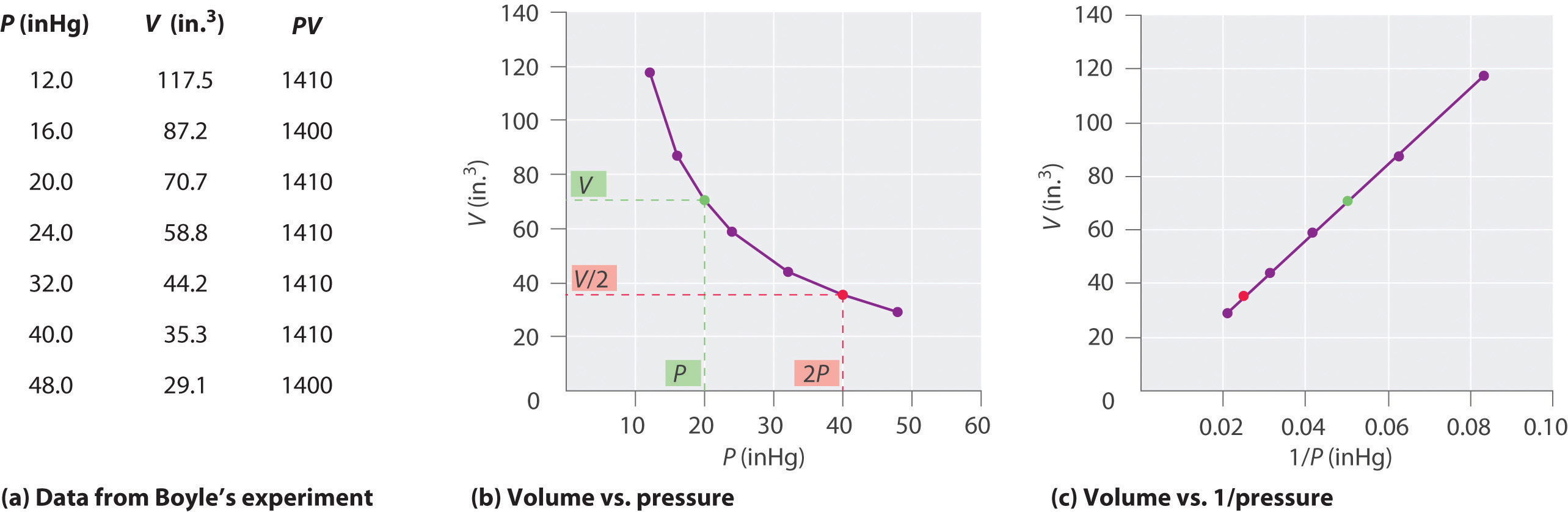
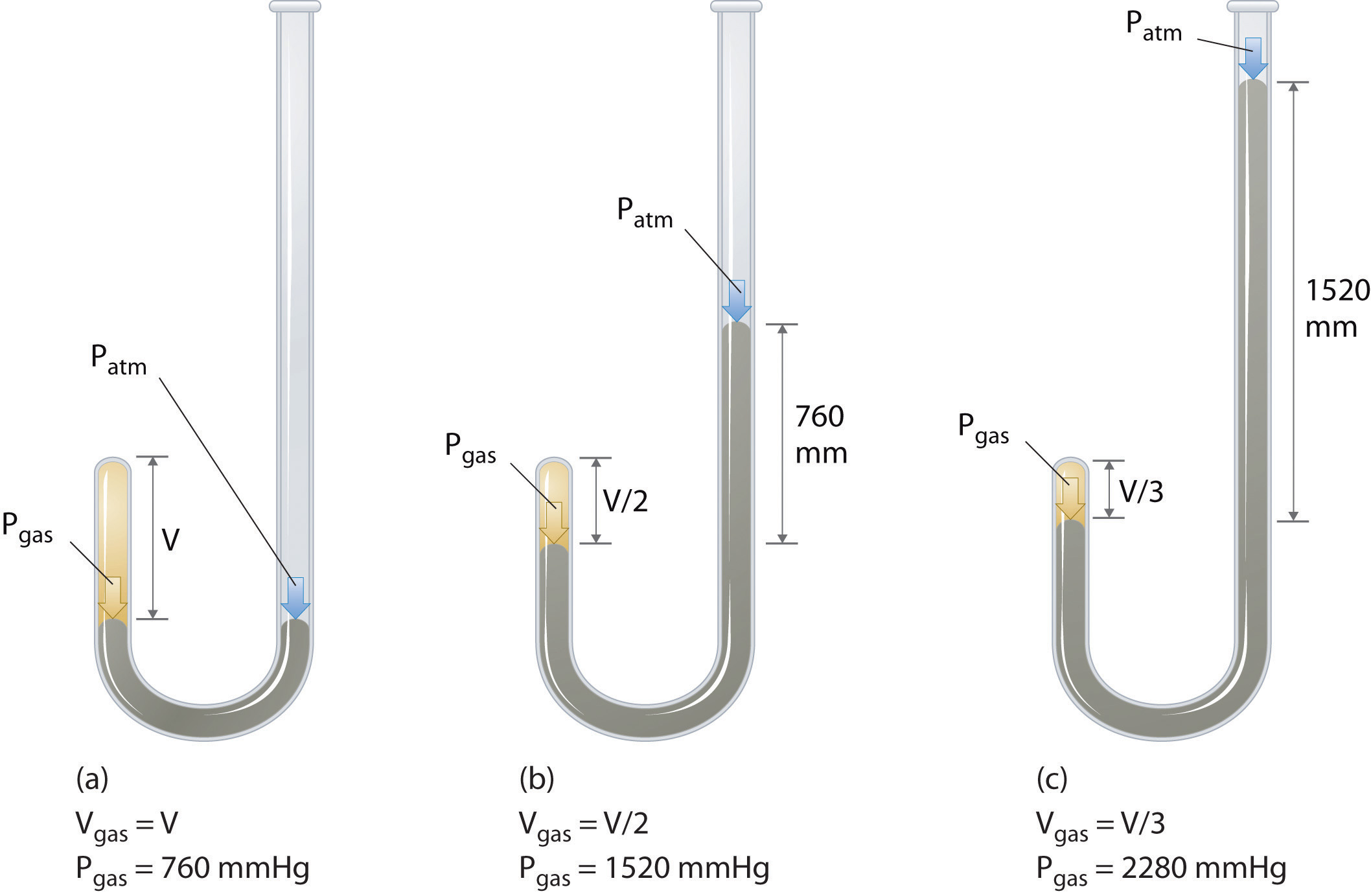
Ca presiunea unui gaz crește, volumul de gaz scade, deoarece gazul particule sunt obligați mai aproape împreună. În schimb, pe măsură ce presiunea asupra unui gaz scade, volumul de gaz crește, deoarece particulele de gaz se pot deplasa acum mai departe., Baloanele meteorologice devin mai mari pe măsură ce se ridică prin atmosferă în regiuni cu presiune mai mică, deoarece volumul gazului a crescut; adică gazul atmosferic exercită o presiune mai mică pe suprafața balonului, astfel încât gazul interior se extinde până când presiunile interne și externe sunt egale.chimistul irlandez Robert Boyle (1627-1691) a efectuat unele dintre primele experimente care au determinat relația cantitativă dintre presiune și volumul unui gaz. Boyle a folosit un tub în formă de J umplut parțial cu mercur, așa cum se arată în figura \(\PageIndex{1}\)., În aceste experimente, o cantitate mică de gaz sau aer este prinsă deasupra coloanei de mercur, iar volumul său este măsurat la presiune atmosferică și temperatură constantă. Mai mult mercur este apoi turnat în brațul deschis pentru a crește presiunea asupra probei de gaz. Presiunea asupra gazului este presiunea atmosferică plus diferența de înălțime a coloanelor de mercur, iar volumul rezultat este măsurat. Acest proces se repetă până când nu mai există spațiu în brațul deschis sau volumul gazului este prea mic pentru a fi măsurat cu precizie., Datele, cum ar fi cele de la unul dintre experimentele proprii ale lui Boyle, pot fi reprezentate în mai multe moduri (figura \(\PageIndex{2}\)). Un complot simplu de \(V\) versus \(P\) dă o curbă numită hiperbolă și dezvăluie o relație inversă între presiune și volum: pe măsură ce presiunea este dublată, volumul scade cu un factor de doi. Această relație dintre cele două cantități este descrisă după cum urmează:
\
Împărțind ambele părți prin \(P\) dă o ecuație care să ilustreze relația inversă dintre \(P\) și \(V\):
\
sau
\
unde ∝ simbol este citit „este proporțională cu.”Un complot de V față de 1/P este astfel o linie dreaptă a cărei pantă este egală cu constanta din ecuația 6.2.1 și ecuația 6.2.3. Împărțirea ambelor părți ale ecuației 6.2.1 la V în loc de P dă o relație similară între P și 1/V., Valoarea numerică a Constantei depinde de cantitatea de gaz utilizată în experiment și de temperatura la care se efectuează experimentele. Această relație între presiune și volum este cunoscută sub numele de legea lui Boyle, după descoperitorul său, și poate fi declarată după cum urmează: la temperatură constantă, volumul unei cantități fixe de gaz este invers proporțional cu presiunea sa.