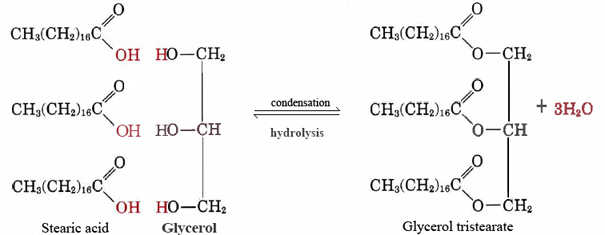
Un bun exemplu de lipide nepolare este tristearat de glicerol grăsime neutră. Această formă cea mai comună de grăsime animală servește ca depozit pentru energie și ca izolație împotriva pierderilor de căldură. La nivel molecular este construit din trei molecule de acid stearic și una de glicerol:
 (1)
(1)
foarte multe lipide nepolare pot fi realizate prin combinarea de diferite lanț lung acizi cu glicerol., Deoarece acești acizi au fost inițial derivați din grăsimi, aceștia sunt denumiți în mod colectiv acizi grași.
observați că pentru fiecare moleculă de acid stearic sau altă moleculă de acid gras care se combină cu una dintre grupurile-OH de glicerol, se eliberează o moleculă de apă și astfel reacția este o condensare. Se pare că multe molecule biologice importante sunt puse împreună prin reacții de condensare în timpul cărora apa este eliberată. Reversul Eq. (1), în care apa reacționează cu o moleculă mare și o împarte în bucăți mai mici, se numește hidroliză., Prin efectuarea hidrolizei, organismele vii pot descompune moleculele fabricate de alte specii. Blocurile simple obținute în acest mod pot fi apoi recombinate prin reacții de condensare pentru a forma structuri adecvate noii lor gazde.spre deosebire de tristearatul de glicerol găsit la animale, grăsimile vegetale conțin numeroase legături duble în lanțurile lor lungi de hidrocarburi. Această polinesaturație introduce „îndoituri” în lanțurile de hidrocarburi datorită barierei de rotație și unghiurilor de 120° asociate cu legăturile duble., În consecință, este mai dificil să aliniați lanțurile una lângă alta (vezi figura \(\PageIndex{1}\) ), iar grăsimile nesaturate nu se împachetează la fel de ușor într-o rețea de cristal. Așa cum a fost adevărat cu alcani, lungimea lanțului determină, de asemenea, dacă o grăsime este lichidă sau solidă și unde are loc punctul de topire.
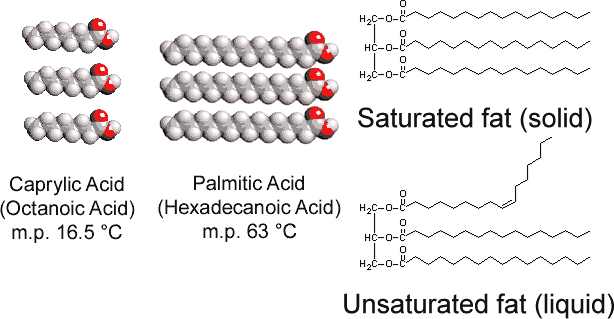
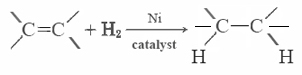
cele Mai multe grăsimi nesaturate (cum ar fi ulei de porumb) sunt lichide la temperaturi obisnuite, in timp ce grasimile saturate (ca untul) sunt solide. Uleiurile vegetale pot fi transformate prin hidrogenare în compuși care sunt solide. Acest proces implică adăugarea catalitică a H2 la legăturile duble:
hidroliza grăsimilor este importantă în fabricarea săpunurilor., Acesta poate fi accelerat prin adăugarea unei baze puternice precum NaOH sau KOH, caz în care reacția se numește saponificare. Deoarece saponificarea necesită ca pH-ul amestecului de reacție să fie ridicat, acidul gras produs se va disocia de anionul său. Când tristearatul de glicerol este saponificat cu NaOH, de exemplu, se formează stearat de sodiu, o substanță relativ solubilă în apă și un săpun comun.capacitatea săpunurilor de a curăța grăsimea și uleiul de pe suprafețele murdare este rezultatul structurilor hidrofobe-hidrofile duale ale moleculelor lor., Ionul de stearat, de exemplu, constă dintr —un lanț de hidrocarburi nepolar lung, cu o grupare COO– polară foarte polară la un capăt.lanțul hidrofob de hidrocarburi încearcă să evite contactul cu mediile apoase, în timp ce grupul anionic adăpostește cu ușurință atracțiile dipolului și legăturile de hidrogen ale moleculelor de apă.cele două căi principale prin care porțiunile hidrofobe de ioni de stearat pot evita apa sunt să se adune la suprafață sau să se dizolve într-o cantitate mică de ulei sau grăsime (vezi figura \(\PageIndex{2}\) ).,
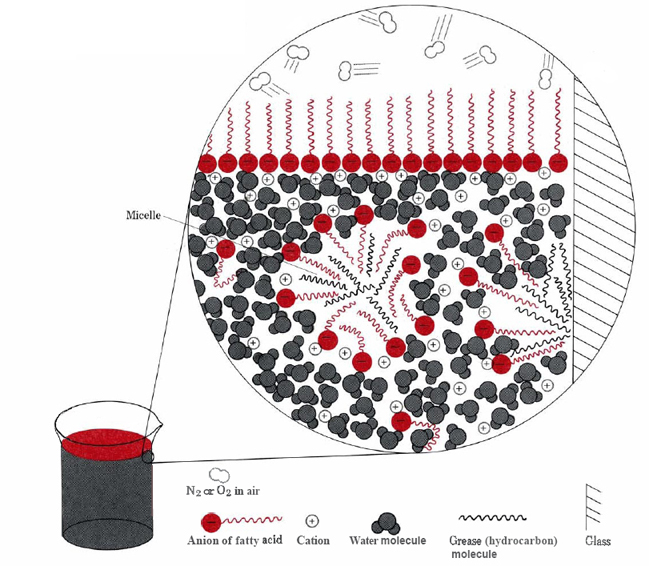
În acest din urmă caz hidrofile șefii de săpun molecule de contact apă în afara grăsime, formând o structură cunoscută ca un miceliu. Deoarece exteriorul micelelor este încărcat negativ, ele se resping reciproc și împiedică recombinarea picăturilor de grăsime., Prin urmare, grăsimea este suspendată (emulsionată) în apă și poate fi spălată cu ușurință.săpunurile naturale, cum ar fi stearatul de sodiu, au fost inițial făcute în casă prin încălzirea grăsimilor animale cu cenușă de lemn, care conținea potasiu, K2CO3. Cantități mari sunt încă produse industrial, dar într-o măsură considerabilă săpunurile au fost înlocuite cu detergenți. Aceasta este o consecință a comportamentului nedorit al săpunurilor în apă tare. Calciul, magneziul și alți cationi de apă dură formează compuși insolubili atunci când sunt combinați cu anionii acizilor grași., Acest lucru produce precipitate scummy și împiedică moleculele de săpun să emulsioneze grăsimea, cu excepția cazului în care se utilizează un exces mare.
Detergenți, cum ar fi alkylbenzenesulfonates (ABS) și liniar alkylbenzenesulfonates (LAS) au structuri foarte similare cu stearat de sodiu cu excepția faptului că a acuzat grupul lor hidrofil capete —SO3– atașat la un inel de benzen. Detergenții ABS au, de asemenea, grupări metil (CH3) care se ramifică în lanțurile lor de hidrocarburi.,
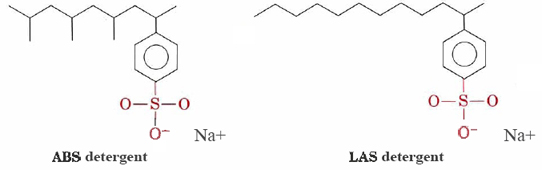
Astfel de molecule nu precipita cu apă tare cationi și, prin urmare, sunt mai potrivite pentru masina de spalat haine. Detergenții LAS au înlocuit ABS la mijlocul anilor nouăzeci și șaizeci, când s-a descoperit că acestea din urmă nu erau biodegradabile. Acestea făceau ca râurile și chiar apa de la robinet să fie acoperite cu spumă de detergent și spumă. Se pare că enzimele din microorganisme care au evoluat pentru a descompune lanțurile de hidrocarburi neramificate din grăsimile naturale și acizii grași au fost incapabile să digere lanțurile ramificate ale moleculelor ABS., Detergenții LAS, deși fabricați de oameni, imită structurile moleculelor care apar în mod natural și sunt biodegradabili.