Introducere
Electronii au nici o poziție fixă în atomi, compuși și molecule (vezi imaginea de mai jos), dar au probabilități de a fi găsite în anumite spații (orbitali). Formele de rezonanță ilustrează zone cu probabilități mai mari (densități de electroni). E ca și cum ți-ai ține pălăria în mâna dreaptă sau în stânga. Termenul de rezonanță se aplică atunci când există două sau mai multe posibilități disponibile., Chimiștii folosesc diagrame Lewis pentru a descrie structura și legarea entităților covalente, cum ar fi moleculele și ionii poliatomici, de acum înainte, moleculele. Cu toate acestea, diagrama Lewis a multor molecule nu este în concordanță cu proprietățile observate ale moleculei.exemplu \(\PageIndex{1}\): Ion nitrat
ionul nitrat, conform diagramei Lewis, are două tipuri de legături azot-oxigen, o legătură dublă și două legături unice, sugerând că o legătură azot-oxigen în ionul nitrat este mai scurtă și mai puternică decât fiecare dintre celelalte două., De asemenea, structura Lewis implică, în ceea ce privește sarcina formală, că există două tipuri de atomi de oxigen în ionul nitrat, unul neutru formal și fiecare dintre celelalte două purtând o sarcină formală de -1. Experimental, totuși, cele trei legături azot-oxigen din ionul nitrat au aceeași lungime de legătură și aceeași energie de legătură, iar cei trei atomi de oxigen sunt indistinguizabili. Diagrama Lewis nu reușește să explice structura și lipirea ionului nitrat în mod satisfăcător.două diagrame Lewis suplimentare pot fi desenate pentru ionul nitrat.,
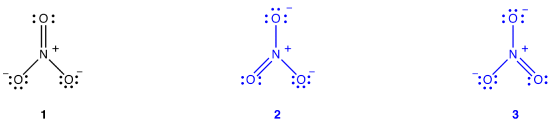
cu toate acestea, niciuna dintre ele nu este în concordanță cu proprietățile observate ale ionului nitrat și, prin urmare, nu prezintă corect ionul nitrat.exemplu \(\PageIndex{2}\): benzen
benzenul, conform diagramei sale Lewis, are două tipuri de legături carbon-carbon, trei legături duble și trei legături unice, sugerând că fiecare dintre cele trei legături carbon-carbon din benzen este mai scurtă și mai puternică decât fiecare dintre celelalte trei. Experimental, însă, cele șase legături carbon-carbon din benzen au aceeași lungime a legăturii și aceeași energie a legăturii., Diagrama Lewis nu reușește să explice structura și lipirea benzenului în mod satisfăcător.un atribut al moleculelor din care diagrama clasică Lewis nu este în concordanță cu proprietățile observate este că alte diagrame Lewis valide pot fi generate pentru ele. O diagramă Lewis suplimentară poate fi trasă pentru benzen.cu toate acestea, niciuna dintre ele nu este în concordanță cu proprietățile observate ale benzenului și, prin urmare, nu prezintă corect benzenul.,teoria rezonanței este o încercare de a explica structura unei specii, cum ar fi ionul nitrat sau benzenul, a cărei diagramă Lewis nu este în concordanță cu proprietățile observate ale speciei. Avantajul major al teoriei rezonanței este că, deși se bazează pe o analiză matematică riguroasă, teoria rezonanței poate fi aplicată cu succes invocând puțin sau deloc matematica. Teoria rezonanței este explicată mai jos folosind ionul nitrat ca exemplu.conform teoriei rezonanței, structura ionului nitrat nu este 1, 2 sau 3, ci media tuturor celor trei, ponderată de stabilitate., Diagramele Lewis 1, 2 și 3 sunt numite forme de rezonanță, structuri de rezonanță sau contribuitori de rezonanță ai ionului nitrat. Se spune că structura ionului nitrat este un hibrid de rezonanță sau, pur și simplu, un hibrid de forme de rezonanță 1, 2 și 3. Ori de câte ori este necesar să se arate structura ionului nitrat, formele de rezonanță 1, 2 și 3 sunt desenate, conectate printr-o săgeată cu două capete.,
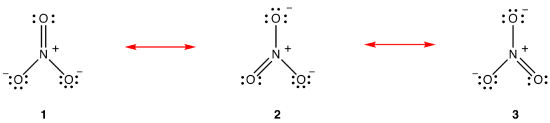
Cele trei forme de rezonanță de nitrat ion, 1, 2, și 3, sunt identice, deci au aceeași stabilitate și, prin urmare, contribuie în mod egal la hibrid., Deoarece exact în măsura în care fiecare rezonanță formă de azotat de ioni contribuie la hibridul este cunoscut, pentru bond de fiecare azot-oxigen de obligațiuni precum și taxa oficială pe fiecare atom de oxigen in hybrid poate fi ușor de determinat:
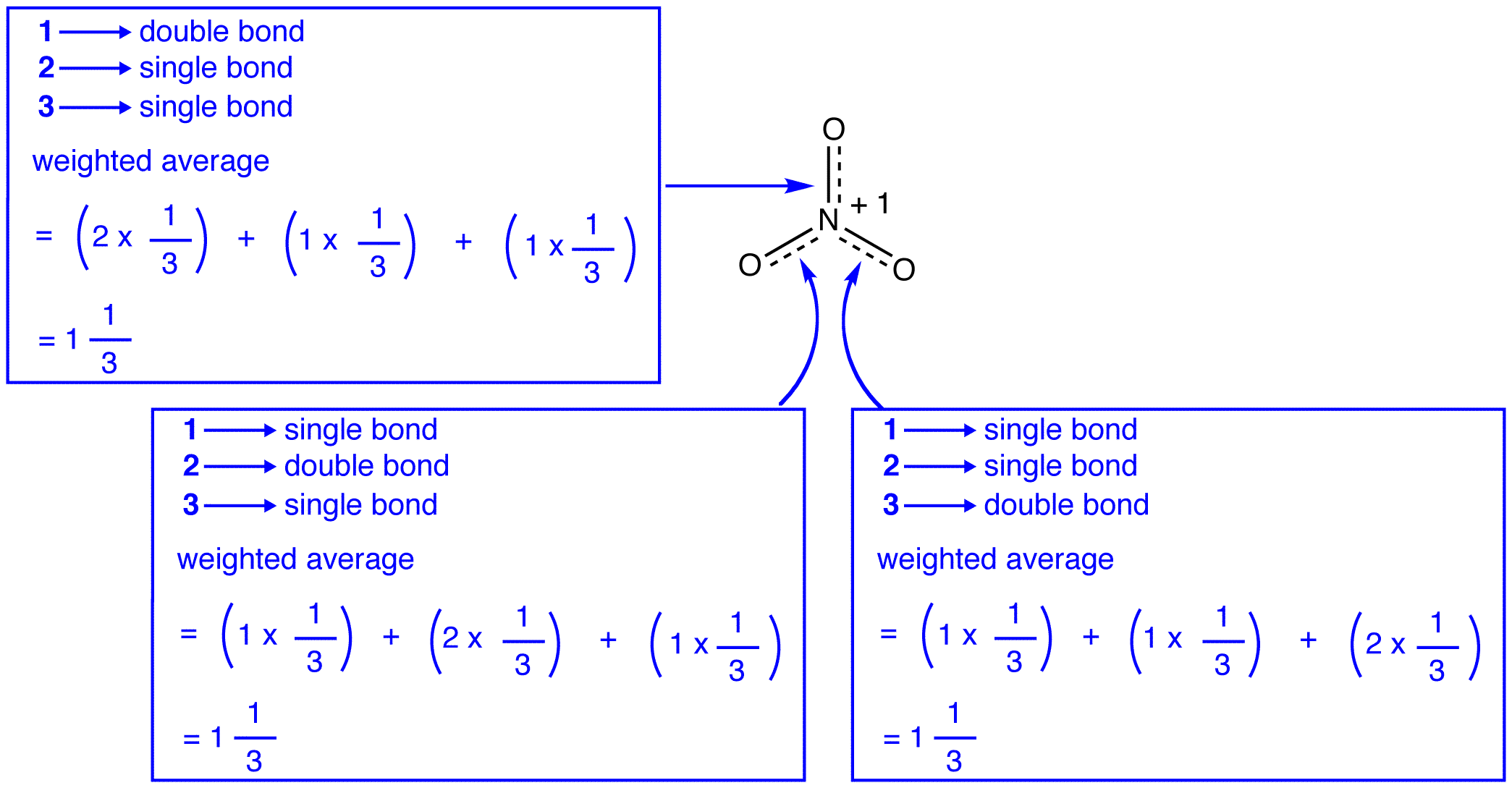
în Conformitate cu rezonanță teorie, fiecare legătură în nitrat ion este unul și o treime din o legătură, care este în concordanță cu observația că cele trei obligațiuni în nitrat ion au același bond lungime și același bond energie.,
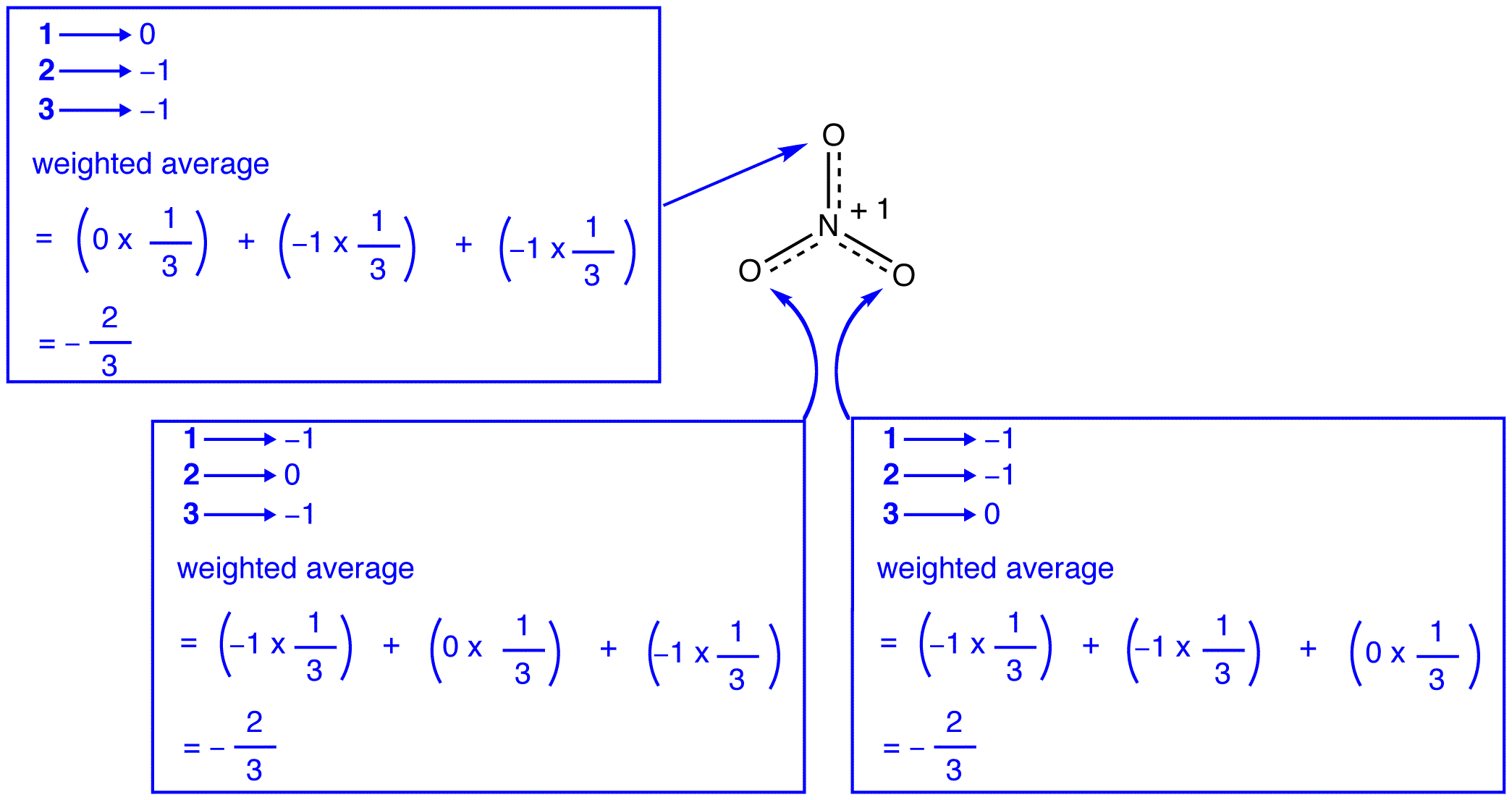
în Conformitate cu rezonanță teorie, fiecare atom de oxigen în nitrat ion are o taxa oficială de -2/3, care, în legătură cu faptul că trei azot-oxigen obligațiuni sunt identice, este în concordanță cu observația că cele trei atomi de oxigen în nitrat ion sunt imposibil de distins. În fiecare formă de rezonanță a ionului nitrat, există doi electroni \(\pi\) și sunt împărțiți numai de doi atomi. Se spune că un electron împărțit doar de doi atomi este localizat., Astfel, cei doi electroni \(\pi\) din fiecare formă de rezonanță a ionului nitrat sunt localizați. Nitrat ion, reprezentată de hibrid, are două \(\pi\) electroni:
- # electronii într-un singur \(\pi\) de obligațiuni = 2
- # electronii într-o treime din o \(\pi\) de obligațiuni = 2/3
- # electroni în trei dintre ele = 3 x (2/3) = 2
Cei doi \(\pi\) electronii în nitrat ion sunt împărtășite de un total de patru atomi, un atom de azot și trei atomi de oxigen. Se spune că un electron împărțit de mai mult de doi atomi este delocalizat. Astfel, cei doi electroni \(\pi\) din ionul nitrat sunt delocalizați., Delocalizarea electronilor \(\pi\) în ionul nitrat necesită ca cei patru atomi să fie pe același plan, permițând suprapunerea laterală a orbitalilor p pe ele.,

în Cazul în care energia de nitrat de ion erau mediu ponderat de energii dintre cele trei forme de rezonanță, doar ca structura de nitrat ion este media ponderată a structurilor sale trei forme de rezonanță, ar trebui să fie egală cu energia de una dintre cele trei identice rezonanță forme:

Dacă energia hibrid au fost egală cu cea de rezonanță de formă, având în vedere că toate entități chimice (particule elementare, atomi, molecule, etc.,) în mod natural tind să fie în cea mai mică stare de energie posibilă, nu ar exista niciun avantaj pentru ionul nitrat să existe ca hibrid; ar putea exista pur și simplu ca formă de rezonanță. Deoarece ionul nitrat există ca hibrid, nu ca formă de rezonanță, se poate deduce că energia hibridului este mai mică decât cea a oricărei forme de rezonanță.

conform teoriei rezonanței, atunci energia unei molecule este mai mică decât cea a formei de rezonanță cu cea mai mică energie., Deoarece ionul nitrat are o energie mai mică și, prin urmare, este mai stabil decât oricare dintre formele sale de rezonanță, se spune că ionul nitrat este stabilizat prin rezonanță.există două concepții greșite despre teoria rezonanței în rândul studenților începători, probabil datorită interpretării literale a cuvântului rezonanță. Acestea sunt descrise mai jos, folosind ionul nitrat ca exemplu.concepția greșită 1: ionul nitrat există ca formă de rezonanță 1 pentru un moment și apoi se schimbă fie în forma de rezonanță 2, fie în forma de rezonanță 3, care se interconvertește, fie revine la 1.,

structura ionului nitrat nu este 1, Nici 2, Nici 3, ci hibridul și nu se schimbă cu timpul decât dacă este supus unei reacții.concepția greșită 2: într-o probă de ioni nitrați, la un moment dat, o treime din ioni există ca formă de rezonanță 1, o altă treime ca formă de rezonanță 2, iar restul de o treime ca formă de rezonanță 3.

într-o probă de ioni nitrați, la un moment dat, toți ionii au aceeași structură, care este hibridul.,analogia clasică folosită pentru a clarifica aceste două concepții greșite este catârul (Morrison, R. T.; Boyd, R. N. Organic Chemistry, fifth edition; Allyn and Bacon: Boston, 1987, pg. 373). Din punct de vedere biologic, un catâr este un hibrid între un cal și un măgar. Acest lucru nu înseamnă că un catâr seamănă cu un cal pentru o clipă și apoi se schimbă pentru a semăna cu un măgar. Apariția unui catâr este o combinație între cea a unui cal și cea a unui măgar și nu se schimbă cu timpul. Nici nu înseamnă că, într-o turmă, unii catâri seamănă cu un cal, iar ceilalți cu un măgar., Într-o turmă, toți catârii au același aspect, care este o combinație între un cal și un măgar. Slăbiciunea acestei analogii este că există cai și măgari, în timp ce formele de rezonanță sunt strict ipotetice. O analogie mai bună, citată în Morrison și Boyd, este rinocerul. Văzând un rinocer, s-ar putea descrie ca fiind hibridul unui dragon și al unui unicorn, două creaturi care nu există.