Objetivos
- Definir corrosão
- Lista de alguns dos métodos utilizados para evitar ou retardar a corrosão
a Corrosão é geralmente definida como a degradação de metais, devido a um processo eletroquímico. A formação de ferrugem em ferro, manchada em prata, e a pátina azul-verde que se desenvolve em cobre são todos exemplos de corrosão., O custo total da corrosão nos Estados Unidos é significativo, com estimativas superiores a meio trilhão de dólares por ano.
talvez o exemplo mais familiar de corrosão seja a formação de ferrugem no ferro. O ferro enferruja quando exposto ao oxigénio e à água. Os principais passos na enferrujação do ferro parecem envolver o seguinte (figura 2). Uma vez exposto à atmosfera, o ferro oxida rapidamente.
os electrões reduzem o oxigénio no ar em soluções ácidas.
o Que podemos chamar de ferrugem é hidratado de ferro(III) óxido que se forma quando o ferro(II) os íons reagem ainda mais com o oxigênio.,
O número de moléculas de água é variável, por isso é representado por x. Ao contrário, a pátina em cobre, a formação de ferrugem não cria uma camada protetora e assim a corrosão do ferro continua como a ferrugem flocos de fora e expõe fresco de ferro para a atmosfera.
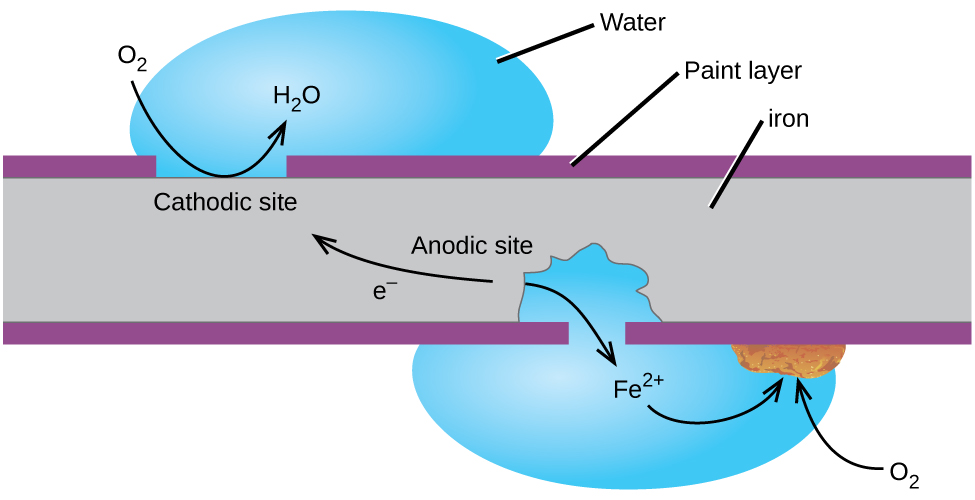
uma maneira de evitar que o ferro se corroa é mantê-lo pintado. A camada de tinta impede que a água e o oxigênio necessários para a formação da ferrugem entrem em contato com o ferro. Enquanto a tinta permanecer intacta, o ferro é protegido da corrosão.,outras estratégias incluem a liga do ferro com outros metais. Por exemplo, aço inoxidável é principalmente ferro com um pouco de crómio. O crómio tende a recolher-se perto da superfície, onde forma uma camada de óxido que protege o ferro.o ferro galvanizado ou galvanizado utiliza uma estratégia diferente. O zinco é mais facilmente oxidado do que o ferro, porque o zinco tem um menor potencial de redução. Uma vez que o zinco tem um menor potencial de redução, é um metal mais ativo. Assim, mesmo que o revestimento de zinco é riscado, o zinco ainda irá oxidar antes do ferro., Isto sugere que esta abordagem deve funcionar com outros metais activos.
outra forma importante de proteger o metal é torná-lo o cátodo em uma célula galvânica. Isto é proteção catódica e pode ser usado para outros metais que não apenas ferro. Por exemplo, a Ferrugem dos tanques e tubos subterrâneos de armazenamento de ferro pode ser evitada ou muito reduzida, conectando-os a um metal mais ativo, como zinco ou magnésio (Figura 3). Isto também é usado para proteger as peças metálicas em aquecedores de água., Os metais mais ativos (menor potencial de redução) são chamados ânodos de sacrifício porque à medida que são usados como eles corroem (oxidam) no ânodo. O metal protegido serve como cátodo, e assim não oxida (corrode). Quando os ânodos são devidamente monitorados e periodicamente substituídos, a vida útil do tanque de armazenamento de ferro pode ser grandemente estendida.
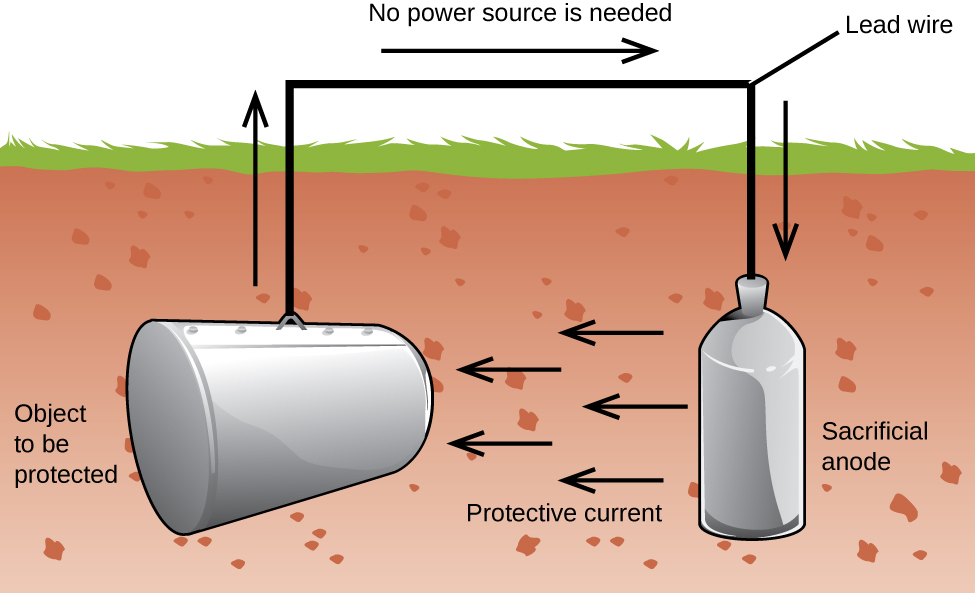
corrosão é a degradação de um metal causada por um processo electroquímico. Grandes somas de dinheiro são gastas todos os anos a reparar os efeitos da corrosão ou a prevenir. Alguns metais, como alumínio e cobre, produzem uma camada protectora quando corroem no ar., A fina camada que se forma na superfície do metal impede que o oxigênio entre em contato com mais átomos de metal e, assim, “protege” o metal restante da corrosão. O ferro corrói (forma ferrugem) quando exposto à água e ao oxigénio. A ferrugem que se forma em metal de ferro escoa, expondo metal fresco, que também corrói. Uma maneira de prevenir ou abrandar a corrosão é revestindo o metal. O revestimento impede a água e o oxigénio de entrar em contacto com o metal. Tinta ou outros revestimentos irão diminuir a corrosão, mas eles não são eficazes uma vez riscados., Ferro galvanizado ou galvanizado explora o fato de que o zinco é mais provável de oxidar do que o ferro. Enquanto o revestimento permanece, mesmo se arranhado, o zinco irá oxidar antes do ferro. Outro método para proteger metais é a proteção catódica. Neste método, um metal facilmente oxidado e barato, muitas vezes zinco ou magnésio (o ânodo sacrificial), é eletricamente ligado ao metal que deve ser protegido. O metal mais ativo é o ânodo sacrificial, e é o ânodo em uma célula galvânica. O metal “protegido” é o cátodo, e permanece não oxidado., Uma vantagem da proteção catódica é que o ânodo sacrificial pode ser monitorado e substituído se necessário.,
Glossário
proteção catódica método de proteção de metal usando um ânodo de sacrifício e faz com que o metal que precisa proteger o catodo, assim, evitando a sua oxidação, corrosão, degradação de metal através de um processo eletroquímico de ferro galvanizado método para a proteção de ferro, cobrindo-os com zinco, que vai oxidar antes de ferro; zinco-chapeado de ferro ânodo de sacrifício de mais activa e mais baratos de metal usado como ânodo na proteção catódica; frequentemente feita a partir de magnésio ou zinco
Soluções
as Respostas a Química Final do Capítulo Exercícios
2., Mg e Zn
4. Ambos os exemplos envolvem proteção catódica. O ânodo (sacrificial) é o metal que corrói (oxida ou reage). No caso do ferro (-0,447 V) e zinco (-0,7618 V), o zinco tem um potencial de redução padrão mais negativo e serve como ânodo. No caso do ferro e do cobre (0,34 V), o ferro tem o menor potencial de redução padrão e assim corrói (serve como ânodo).6., Enquanto o potencial de redução do lítio o tornaria capaz de proteger os outros metais, este alto potencial também é indicativo de como o lítio é reativo; ele teria uma reação espontânea com a maioria das substâncias. Isto significa que o lítio reagiria rapidamente com outras substâncias, mesmo aquelas que não oxidificariam o metal que está tentando proteger. Reatividade como esta significa que o ânodo sacrificial seria rapidamente esgotado e precisa ser substituído com frequência. (Razão adicional facultativa: perigo de incêndio na presença de água.)