Introduction
Nuclear factor kappa B (NF-kB) is an ancient protein transcription factor (Salminen et al., 2008) e considerado um regulador da imunidade inata (Baltimore, 2009). A via de sinalização NF-kB liga sinais patogênicos e sinais de perigo celular, organizando resistência celular a patógenos invasores., Na verdade, uma infinidade de estudos têm mostrado que NF-kB é um centro de rede responsável pela sinalização biológica complexa (Albensi e Mattson, 2000; Kaltschmidt e Kaltschmidt, 2009; Karin, 2009). Para este fim, a hipótese de NF-kB ser um regulador mestre de cascatas bioquímicas conservadas evolutivamente (Mattson et al., 2000). Outros fatores também são translocados para a mitocôndria e estão envolvidos na expressão modular (Barshad et al., 2018a), mas não são o foco desta revisão., O objetivo desta revisão é tentar entender como a atividade NF-kB contribui para a função mitocondrial. Assume-se que o leitor já tem uma compreensão da biologia mitocondrial básica. No caso de um estudo mais aprofundado, o leitor é referido muitas excelente estudos e análises sobre a estrutura e função mitocondrial (Hall, 1979; Fox, 1982; Roger e Silberman, 2002; Henze e Martin, 2003; Conradt, 2006; Ettema, 2016; Wang e Youle, 2016; Barshad et al., 2018b).,
ativação NF-kB
subunidades do fator Nuclear kappa B, compreendendo o complexo NF-kB, são expressas tanto em neurônios quanto em glia. O complexo NF-kB existe em um estado inativo no citoplasma (Ghosh et al., 1998; Aggarwal et al., 2004; Hayden e Ghosh, 2004) onde a ativação de NF-kB tem sido bem descrita (Li e Karin, 2000; Baud e Jacque, 2008; Israel, 2010). Quando estimulado por moléculas tais como TNFa, ou outros factores de stress celular, o TNFa liga-se aos receptores TNF (Figura 1)., Esta ligação, através de várias etapas intermédias, conduz a uma interacção com o complexo IkB kinase (IKK), que conduz então à fosforilação do IkB, resultando subsequentemente na ubiquitinação e degradação do IkB. Uma vez degradado, o dímero NF-kB restante (por exemplo, subunidades p65/p50) translocata para o núcleo, onde se liga à sequência de consenso de DNA de vários genes-alvo. A seletividade da resposta NF-kB é baseada em vários fatores (Sen e Smale, 2010), incluindo composição dímero, timing e tipo de célula., A influência de NF-kB na sobrevivência celular também é complexa e pode ser neuroprotectiva ou pró-inflamatória, dependendo do tipo celular, estágio de desenvolvimento e estado patológico (Qin et al., 2007).
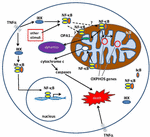
a Figura 1. Vias para o factor Nuclear κ B (NF-kB) sinalizando no citoplasma e na mitocôndria. O complexo Tri-subunt NF-kB (P65, p50, IkB – uma combinação possível) existe em um estado inativo no citoplasma. A ativação NF-kB é iniciada quando moléculas como TNFa se ligam aos receptores TNF (existem diferentes tipos)., Outros estímulos externos ou internos também podem ativar NF-kB. Um processo complicado de transdução de sinal então começa uma vez que os receptores TNF são ativados; IkB kinase (IKK) é finalmente ativado e leva à fosforilação do IkB, o que resulta em ubiquitinação IkB e degradação. Uma vez que IkB é degradado, o dímero NF-kB restante (por exemplo, combinações de subunidades p65/p50 ou p50/p50 são possíveis) é translocado para o núcleo, onde se liga a uma sequência de consenso de DNA de genes-alvo., Por processos não bem compreendidos, o complexo NF-kB ou subunidades NF-kB também podem migrar para a mitocôndria, onde evidências sugerem que ocupam o espaço intermembranar. Uma vez dentro da mitocôndria, acredita-se que NF-kB interage com os genes OXFOS (mtDNA mitocondrial) que leva à expressão de proteínas envolvidas em várias funções, incluindo dinâmica mitocondrial e regulação COX III (componente do complexo IV)., Evidências também sugerem que NF-kB pode funcionar como um interruptor na mitocôndria e controlar o equilíbrio entre a utilização de glicólise citoplásmica e respiração mitocondrial em células normais e no câncer. Finalmente, os dados também apontam para estimulação da via apoptótica intrínseca, onde a ativação NF-kB na mitocôndria leva à liberação do citocromo c, desencadeando assim Cascatas Da caspase e morte celular programada.,
Organizacionalmente, NF-kB é um Rel família do fator de transcrição, e está associado com cinco genes, NF-kB1, NF-kB2, RELA, RELB, e REL (Chen e Greene, 2004); estes genes codificam várias proteínas, NF-kB1, NF-kB2, RelA, RelB, e c-Rel, respectivamente, onde duas destas proteínas são grandes precursores de proteínas, conhecidas como p105 e p100 que se submeter a proteólise para se tornar p50 e p52, respectivamente. Estas proteínas contêm domínios de REL-homologia (RHD) na sua região amino-terminal; a região RHD é composta por 2 domínios separados, mas adjacentes., A sequência mais distante da região carboxi-terminal permite que a proteína se ligue ao DNA. Uma sequência mais interior permite que as proteínas da família Rel dimerizem (homo-ou heterodímeros) para a supressão da expressão através da ligação de sua família correspondente de inibidores, as proteínas IkB (Chen e Greene, 2004). Esta última sequência inclui a sequência de localização nuclear (NLS) que se desmascara quando o IkB não é consolidado pela degradação. O NLS tem o trabalho de orientar ou marcar proteínas ativas para importação para o núcleo celular (Chen e Greene, 2004; Karin et al., 2004; Barger et al.,, 2005).três destas proteínas (RelA, RelB e C-REL) também codificam um domínio de transativação (TADs) na sua região carboxi-terminal. Os TADs permitem que essas proteínas interajam com o aparelho de transcrição basal, conhecido como a proteína de ligação TATA (TBP), o Fator de transcrição IIB, bem como o P300 e o elemento de resposta do campo (CREB) proteína de ligação (CBP) co-Ativadores de transcrição (Chen e Greene, 2004)., Apenas estas três proteínas são capazes de induzir a transcrição das suas regiões codificadoras de ADN, enquanto as outras proteínas, os homodímeros p50 e p52, são capazes de ocupar os locais de ligação do ADN sem iniciar a transcrição. Dado isto, as mais recentes 2 homodimers proteins de p50 e p52 atuam como repressores transcritionais (Chen e Greene, 2004).
os homodímeros P105 e p100 ocupam locais de ligação ao ADN, bloqueando assim a transcrição através de factores de transcrição que possuem TADs (Barger et al., 2005). Uma terceira forma de repressão transcritional é devida às proteínas do IkB., Estas proteínas têm várias repetições anquirinas como seu domínio Central e função, ligando-se ao RHD que mascara as NLS (Karin et al., 2004). Sem um NLS ativo, as proteínas NF-kB são restritas ao citoplasma e são incapazes de migrar para o núcleo e assim a transcrição é bloqueada.
NF-kB Is Found in the Mitochondria
In 2001, a study by Bottero et al. (2001) found IkBa and the NF-kB p65 subunit in subcelular fractions and purified mitochondria from Jurkat cells. As células Jurkat são uma linha de células imortalizadas de linfócitos T humanos que são usados para estudar leucemia., No estudo de Bottero, foi determinado que IkBa e NF-kB p65 foram localizados no espaço intermembranar mitocondrial. O espaço intermembranar mitocondrial é o espaço que existe entre a membrana mitocondrial interna (IMM) e a membrana mitocondrial exterior (OMM).subsequentemente, Cogswell et al. (2003) also showed that NF-kB subunits, p50 and p65, and IkBa, were found in the mitochondria. Para determinar isso, vários métodos foram usados para fornecer evidências, incluindo microscopia eletrônica de seções de células U937., As células U937 foram primeiro isoladas do linfoma de um paciente do sexo masculino de meia-idade para estudar o comportamento e diferenciação dos monócitos. Aqui Cogswell et al. (2003) was able to visualize NF-kB p50 and p65 subunits and IkBa in the inner matrix of the mitochondria. Neste estudo foram também examinadas as células hepáticas de rato, tendo sido igualmente identificadas as subunidades p50 e IkBa. Adicionalmente, as células U937 foram estimuladas por 1 h com TNFa, um gatilho conhecido da via de sinalização NF-kB., Neste experimento, análises Western blot em frações mitocondriais e citoplásmicas descobriram que o tratamento com TNFa causou uma perda de IkBa tanto nos compartimentos mitocondriais quanto citoplásmicos em 30 minutos após o tratamento sugerindo que o IkBa foi degradado. A análise EMSA, um ensaio in vitro que detecta a activação de NF-kB e a ligação não específica às sequências de ADN, também foi realizada em proteínas obtidas a partir de extractos nucleares de mitocôndrias isoladas a partir de células U937 estimuladas com TNFa., Aqui determinaram a sinalização do TNFa levou a uma maior actividade de ligação do ADN de P50 NF-kB, em proteínas retiradas das mitocôndrias.outros estudos também detectaram NF-kB na mitocôndria. Estes incluem estudos (Guseva et al., 2004; Zamora et al., 2004) in human fibroblast HT1080 cell lines, human próstata LNCaP and PC3 cell lines, and HeLa cells. Nas células LNCaP, foram encontradas subunidades mitocôndrias NF-kB p50 e p65 ligadas ao DNA mitocondrial (mtDNA)., Em conjunto, estes estudos mostram evidências para a sinalização NF-kB na mitocôndria e que NF-kB regula a expressão de mRNA mitocondrial (ver seção de expressão do gene NF-kB e mitocondrial abaixo).
NF-kB Controles Mitocondrial Dynamics
Existem várias proteínas envolvidas na dinâmica (fissão e fusão) e a morfologia das mitocôndrias (Karbowski e Youle, 2003; Olichon et al., 2006; Brooks and Dong, 2007; Song et al., 2008; Autret e Martin, 2010; Silva et al., 2013; Sinha e Manoj, 2019). Uma delas é a proteína atrofia óptica 1 (OPA1) (Olichon et al.,, 2006; Garcia et al., 2018; Lee and Yoon, 2018). Estudos têm sugerido que OPA1 é um regulador da fusão da membrana interna mitocondrial e também remodelação mitocondrial cristae (Cipolat et al., 2006). Recentemente Laforge et al. (2016) showed that the absence of IKKa had an impact on OPA1 expression in the mitochondria and on mitochondrial morphology.surpreendentemente, num estudo recente realizado por Nan et al. (2017), TNFa recept 2 (TNFR2) stimulation was found to promote mitochondrial fusion via the NF-kB-dependent activation of OPA1 expression in cardiac myocytes., Importante, a ativação do TNFR2 neste estudo protegeu os miócitos cardíacos contra o estresse através da regulação da expressão OPA1. Ao administrar baixas concentrações de TNFa exógena (0, 5 ng/mL) antes de isquemia-reperfusão pareceu aumentar a sobrevivência celular, enquanto concentrações mais elevadas (10-20 ng/mL) levaram a efeitos tóxicos nas células.
NF-kB and Apoptosis in the Mitochondria
Mitochondria’s role in programed cell death, or apoptosis has been known for quite some time (Green and Reed, 1998; Wang and Chen, 2015)., O papel mais importante para a mitocôndria é a geração de ATP; no entanto, a segunda função mais importante para a mitocôndria é, provavelmente, no controle da morte celular. Como é que as mitocôndrias fazem isto? Se a mitocôndria falha no desencadeamento da morte celular, o câncer é muitas vezes a consequência. Assim, a fim de regular a morte celular, a mitocôndria integra sinais de uma variedade de fontes, que são conhecidas como vias intrínsecas de apoptose. Componentes da atividade NF-kB parecem ser um desses sinais, embora TNFa, um ativador de NF-kB, seja parte de uma via extrínseca de apoptose., As vias extrínsecas (mediadas pelo receptor da morte) são iniciadas fora da célula, enquanto as vias intrínsecas de apoptose são mediadas e desencadeadas na mitocôndria.num estudo recente realizado por Pazarentos et al. (2014), IkBa was found to exercise pro-apoptotic activity as it inhibited the anti-apoptotic NF-kB. Na maioria das células, a ativação de NF-kB leva à expressão do gene alvo a jusante que desencadeia a resistência à morte celular (Luo et al., 2005). Neste estudo, foi demonstrado que uma nova função de apoptose era devida à IkBa, a subunidade que inibe a ativação de NF-kB. Pazarentzos et al., (2014) descobriu que IkBa localiza a OMM, onde interage com uma tensão dependente ânion canal (VDAC) e mitocondrial hexoquinase II (HKII) para estabilizar a este complexo e evitar Bax mediadas pela liberação de citocromo c para a apoptose. Bax é um membro da família Bcl-2 de proteínas, que tem sido mostrado para ser reguladores da morte celular programada (Karbowski et al., 2006).outros estudos também sugeriram o papel de NF-kB na apoptose mais diretamente reguladora na mitocôndria. In a study by Liu et al., (2004), a inibição do NF-kB sozinho em macrófagos resultou na libertação de citocromo c. De recordar que o citocromo c é responsável pelo vaivém de elétrons do Complexo III Complexo IV e que a liberação do citocromo c para o citoplasma, um ativador de passos, é um passo importante no desencadeamento da apoptose.
NF-kB and mitocondrial Respiration
Nuclear factor kappa B has been shown in many studies to promote tumorigenesis. O modo como isto ocorre não foi exactamente claro. In a groundbreaking study by Mauro et al., (2011), NF-kB was found to upregulate mitochondrial respiration in colon carcinoma cells. Aqui eles estabeleceram que esta função de NF-kB suprime o efeito de Warburg. Lembre-se que o efeito Warburg (Vander Heiden et al., 2009) descreve a observação de que as células cancerígenas tendem a favorecer o metabolismo por glicólise ao invés da via de fosforilação oxidativa mais eficiente. Assim, neste estudo, os autores determinaram que NF-kB organiza redes de metabolismo energético controlando o equilíbrio entre a utilização de glicólise e a respiração mitocondrial., Curiosamente, eles encontraram um papel para NF-kB na adaptação metabólica em células normais e no câncer. Os seus resultados sugeriram ainda que a supressão do metabolismo mitocondrial em células cancerígenas estabelecidas por inibição de NF-kB e metformina diminui a tumorigénese.
NF-kB and Mitochondrial Gene Expression
Nuclear factor kappa B is a known regulator of gene expression-both negative and positively (Mattson et al., 2000). However, how NF-kB regulates or influences nuclear-encoded mitochondrial gene expression is less understood., O mtDNA humano possui 37 genes que codificam 13 polipeptídeos. It has been shown that mtDNA genes code for many of the subunits of all 5 complexes of the electron transport chain (ETC), 2 rRNAs, and 22 tRNAs. Embora, a maioria das subunidades ETC são codificadas por DNA nuclear, o que pode ser influenciado pela atividade NF-kB (Calvo et al., 2016).por exemplo, foi alegado (Cogswell et al., 2003) that the NF-kB pathway can negatively regulate mitochondrial gene expression associated with the COX III subunit., A subunidade COX III é codificada por mtDNA e é um componente do complexo IV no mitocondrial, ETC. Ele funciona como uma subunidade catalítica no complexo IV, que é o complexo associado com o consumo de oxigênio mitocondrial. In a study by Cogswell et al. (2003), modulation of NF-kB activation resulted in the loss of expression of both COX III and cytocrome b mRNA. Outros estudos suportam um papel para NF-kB regulando genes mitocondriais adicionais, como COX i, e Cytb (Psarra e Sekeris, 2008, 2009; Barshad et al., 2018b)., Adicionalmente, a subunidade P65 NF-kB reduziu os níveis de mRNA do CITB codificado por mtDNA, possivelmente ligando-se ao Ciclo D nas células humanas na ausência de p53 (Johnson et al., 2011). Globalmente, estes resultados sugerem que a sinalização NF-kB pode influenciar a actividade enzimática dos complexos respiratórios ETC.
NF-kB Medeia Aß Induzida por Disfunção da Mitocôndria
a doença de Alzheimer (AD) é associado com o acúmulo de Aß placas e/ou o aparecimento de emaranhados neurofibrilares (NFTs), em certas regiões do cérebro (Duyckaerts et al., 2009)., No entanto, existe controvérsia sobre se Aß é um agente causador de AD ou se Aß é simplesmente correlacionada com o envelhecimento. Acumulando provas (Aiev et al., 2009; Correia et al., 2012; Cadonic et al., 2016; Cardoso et al., 2017; Djordjevic et al., 2017) também aponta para mudanças no metabolismo cerebral impulsionadas pela disfunção mitocondrial como um processo central para muitas doenças neurodegenerativas relacionadas com a idade, incluindo AD. Somando-se a esta evidência, há também comprometimentos na atividade enzimática dos complexos proteicos do ETC e alterações na atividade enzimática antioxidante (Kolosova et al.,, 2017) in AD. Em particular, a actividade IV complexa tem sido afectada negativamente na AD (Mutisya et al., 1994).num estudo recente realizado por Shi et al. (2014), it was found that aß impaired mitochondrial function via NF-kB signaling. Além disso, Shi et al. (2014) mostrou aqui que Aß diminuiu a expressão da subunidade COX III através de uma via NF-kB., Importante, para eliminar a possibilidade de que IkBa foi fosforilada pela Aß no citoplasma (e, em seguida, transportado para a mitocôndria), mitocôndrias isoladas foram incubadas com Aß na presença (ou ausência) de uma NF-kB bloqueador, nomeadamente BAY11-7082. Aqui encontraram fosforilação induzida por Aß e degradação do IkBa em mitocôndrias isoladas.estes resultados também têm implicações importantes para o tratamento da AD, como demonstrado por estudos recentes de Snow et al. (2018) e como demonstrado noutros estudos relacionados (Djordjevic et al., 2017; Adlimoghaddam et al.,, 2019) que sugerem que a sinalização NF-kB na mitocôndria pode ter valor terapêutico. Por exemplo, em Snow et al.o estudo da creatina – um modulador conhecido da função mitocondrial (Tarnopolsky e Beal, 2001) demonstrou aumentar e alterar positivamente os níveis de proteínas de CaMKII, PSD-95 e subunidades complexas 1 em ratinhos alimentados com creatina, enquanto a subunidade IkB inibidora NF-kB diminuiu. Para uma leitura adicional sobre o potencial efeito terapêutico da creatina na função mitocondrial e em doenças mitocondriais ou outras doenças neurológicas, ver estudos e revisões por Matthews et al., (1998), Klivenyi et al. (1999), Tarnopolsky and Beal (2001), Hersch et al. (2006), Rodriguez et al. (2007) e Beal (2011).
NF-kB ‘ s Role in Inflamation and Mitochondrial Metabolism
Increasing data (Lamas et al., 2003; Mauro et al., 2011; Moretti et al., 2012) estão sugerindo que a sinalização NF-kB, que é um mediador de processos inflamatórios, também está funcionando como um regulador e integrador com metabolismo energético. In a recent study by Zhong et al. (2016), NF-kB was shown to restrict inflamsasome activation via elimination of damaged mitochondria., Surpreendentemente, o NF-kB pareceu purgar o nlrp-3 inflamasoma para activação e também preveniu inflamação excessiva e a activação do nlrp-3 inflamasoma; embora o mecanismo de contenção tenha sido mal definido. Especulou-se que, além de NF-kB ser um ativador de genes inflamatórios, também funcionou neste estudo limitando a ativação de nlrp3 inflamasomas e a produção IL-1β. Além disso, verificou-se que a indução do p62 foi responsável pela actividade inibidora do inflamassoma por NF-kB., Parece que NF-kB pode conter a sua própria inflamação nos macrófagos, promovendo a remoção mediada por p62 das mitocôndrias danificadas (mitofagia) após os macrófagos interagirem com diferentes activadores inflamasomas NLRP3.
Conclusion
Over 10 years ago, NF-kB was detected in the mitochondria. Surpreendentemente, para um fator de transcrição tão importante, pouco progresso tem sido feito na descoberta de papéis específicos para NF-kB que afetam a mitocôndria., Alguns estudos, como descrito acima, fornecem evidências para NF-kB em dinâmica mitocondrial, apoptose, controle respiratório, expressão genética e mecanismos da doença (Figura 1). No entanto, a duplicação destes resultados e a validação global continuam a ser necessárias por outros laboratórios. Algumas informações adicionais podem ser obtidas a partir do fato de que outros fatores de transcrição ter efeitos nos genes nucleares, tais como AP-1, p53, CREB, c-Myc, Wnt13, Dok-4, HMGA1, e c-Src também foram detectados na mitocôndria (Psarra e Sekeris, 2008)., Curiosamente, sítios de ligação no genoma mitocondrial (homólogo aos seus locais de ligação no ADN nuclear) para alguns destes factores foram determinados (Psarra e Sekeris, 2008) onde os papéis para a transcrição mitocondrial e apoptose são suspeitos e mostram alguns padrões globais de actividade. Por exemplo, um argumento pode ser feito que alguns destes fatores (NF-kB, CREB e AP-1) se ligam aos genomas mitocondriais e atenuam principalmente a expressão do gene mitocondrial (Blumberg et al., 2014), enquanto tendo efeitos estimuladores na transcrição de genes nucleares., No entanto, é claramente necessário mais trabalho para não só encontrar papéis precisos de actividade, mas também para determinar se os padrões globais de actividade realmente existem.
Depois de examinar esta literatura, também se torna evidente que o papel de NF-kB na regulação da respiração mitocondrial tem implicações profundas e demonstra um nível de complexidade não previamente apreciado. Por exemplo, Mauro et al. (2011) data establish a role for NF-kB in metabolic adaptation in normal cells and in cancer, and also suggest consequences for other disease states such as AD., Além disso, dado que NF-kB pode conter sua própria inflamação como mostrado por Zhong et al. (2016), não só é surpreendente, mas exemplifica ainda mais a complexidade da sinalização NF-kB na função mitocondrial.nesta revisão, estudos foram pesquisados sobre o papel de NF-kB na função mitocondrial, e parece que a pesquisa nesta área está aumentando. Complicando os resultados, porém, é a observação de que múltiplos fatores estão desempenhando papéis semelhantes na função mitocondrial, pelo que são necessários estudos detalhados específicos para cada fator., Em conclusão, podemos voltar a fazer a pergunta – O que é NF-kB fazendo dentro e para a mitocôndria? A resposta imediata e abreviada seria-muito!
contribuições do autor
o autor criou o tópico e escreveu o manuscrito.Este trabalho foi apoiado pelo financiamento do Canadian Institutes of Health Research (CIHR), Canadian Agricultural Partnership (CAP), St.Boniface Hospital Research Foundation, Alzheimer Society of Manitoba, Research Manitoba, The Honourable Douglas and Patricia Everett, e Royal Canadian Properties Limited Endowment Fund.,
Declaração de conflito de interesses
o autor declara que a investigação foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
agradecimentos
o autor gostaria de agradecer ao Dr. Grant Hatch por uma revisão do manuscrito.
Hayden, M. S., and Ghosh, S. (2004). Sinalizando para NF-kappaB. Genes Dev. 18, 2195–2224.
PubMed Abstract | Google Scholar
Wang, X. and Chen, X. J. (2015)., Uma rede citosólica suprimindo o stress proteostático mediado pela mitocôndria e a morte celular. Nature 524, 481-484. doi: 10.1038/nature14859
PubMed Abstract | CrossRef Full Text | Google Scholar