A Brønsted-Lowry Teoria de Ácidos e Bases
Brønsted-Lowry teoria de ácidos e bases tomou a definição de Arrhenius é um passo a mais, como uma substância que não é mais necessário para ser composto de hidrogênio (H+) ou hidróxido (OH-) íons para ser classificado como um ácido ou base. Para exmapl, considere a seguinte equação química:
\
- um ácido Brønsted-Lowry é um doador de prótons (íon hidrogênio).uma base Brønsted-Lowry é um aceitador de prótons (íon hidrogênio).,
nesta teoria, um ácido é uma substância que pode libertar um próton (como na teoria de Arrhenius) e uma base é uma substância que pode aceitar um próton., Um sal de base, tais como Na+, F-, gera OH – íons na água, tirando os protões da água (para fazer HF):
\
- Ácido, a dissociação
\
- Ácido Constante de Ionização:
\}{}\]
- da Base de dados de dissociação:
\
- Base de Ionização Constante
\}{}\]
A determinação de uma substância como um Brønsted-Lowery ácido ou da base de dados só pode ser feito observando-se a reação. No caso do HOH é uma base no primeiro caso e um ácido no segundo caso.,
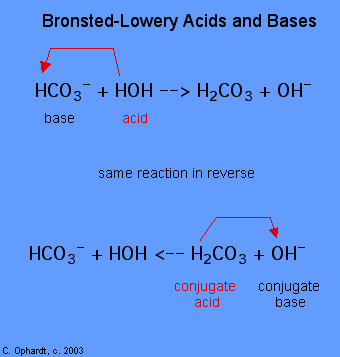
para determinar se uma substância é um ácido ou uma base, conte os hidrogénios em cada substância antes e depois da reacção. Se o número de hidrogénios diminuiu, essa substância é o ácido (Doa iões de hidrogénio). Se o número de hidrogénios aumentou essa substância é a base (aceita íons de hidrogénio). Estas definições são normalmente aplicadas aos reagentes à esquerda. Se a reação é vista ao contrário, um novo ácido e base podem ser identificados., As substâncias do lado direito da equação são chamadas ácido conjugado e base conjugada em comparação com as da esquerda. Note também que o ácido original se transforma na base conjugada após a reação terminar.Nota: Os ácidos são dadores de protões e as Bases são Aceitadores de protões para que uma reacção esteja em equilíbrio, é necessário que ocorra uma transferência de electrões. O ácido dará um elétron e a base receberá o elétron. Ácidos e Bases que trabalham juntos desta forma são chamados de par conjugado composto de ácidos conjugados e bases conjugadas.,
\
A representa um composto ácido e Z representa um composto básico
- a DOA Hz+.
- Z Aceita H a partir de Um que faz HZ+
- Um – torna-se o conjugado da base de dados de HA e no reverso da reação aceita um H de HZ para recriar HA, a fim de permanecer em equilíbrio
- HZ+ torna-se um ácido conjugado de Z e no reverso da reação doa um H – recriando Z, a fim de permanecer em equilíbrio