The 1913 Bohr model of the hydrogen atom was replaced by Schrodingerʹs wave mechanical model in 1926. No entanto, o modelo de Bhrʹs ainda é profitavelmente ensinado hoje por causa de sua simplicidade conceitual e matemática, e porque introduziu uma série de idéias chave da mecânica quântica, tais como o número quântico, quantização de propriedades observáveis, salto quântico e estado estacionário.,
Bohr calculou a variedade de energias elétricas permitidas, equilibrando as forças mecânicas (núcleo centrípeta e elétron) em um elétron executando uma órbita circular de raio r sobre o núcleo, e, em seguida, quantificando seu momento angular. Finally by fiat he declared that the electron was in a non-radiating stationary state because an orbiting (accelerating) charge radiates energy and will collapse into the oppositely charge nucleus.,
em 1924 de Broglie postulou dualidade onda‐partícula para o elétron e outras partículas maciças, proporcionando assim a oportunidade de remover parte da Arbitragem do modelo de Bhrʹs. Por exemplo, um elétron possuindo propriedades de onda está sujeito a interferência construtiva e destrutiva. Como será mostrado isto leva naturalmente à quantização do momento do elétron e da energia cinética, e consequentemente uma variedade de estados de energia permitidos para o elétron em relação ao núcleo., O modelo de Broglie-Bohr do átomo de hidrogênio aqui apresentado trata o elétron como uma partícula em um anel com propriedades de onda.
\
a hipótese de Broglie de que a matéria tem propriedades ondulantes.
\
a consequência da hipótese de Broglieʹs; um número integral de comprimentos de onda deve caber dentro da circunferência da órbita. Isto introduz o número quântico que pode ter valores 1,2,3,… O estado de n = 4 elétrons é mostrado abaixo.,
\
Substituição da primeira equação na segunda equação revela que o momentum é quantizada.
\
Se o momento é quantizado, a energia cinética também é.o que significa que a energia total é quantizada. O segundo termo é a energia eletrostática do potencial elétron‐próton.
A interpretação mecânica quântica destas órbitasʺbohr é que elas são estados estacionários. Apesar de usarmos a expressão energia cinética, que implica movimento de elétrons, não há movimento., O elétron ocupa a órbita como uma onda de partículas, não está orbitando o núcleo. Se estivesse orbitando em um sentido clássico, irradiaria energia e rapidamente colapsaria no núcleo. Claramente a estabilidade da matéria requer a versão mecânica quântica da energia cinética.
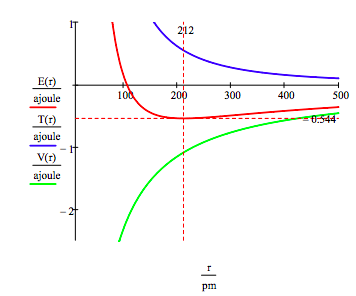
a energia do Estado do solo e o raio de órbita do elétron no átomo de hidrogênio é encontrado por traçar a energia como uma função do raio orbital. O estado do solo é o mínimo na curva de energia total., Naturalmente o cálculo pode ser usado para obter a mesma informação minimizando a energia em relação ao raio da órbita. No entanto, o método gráfico tem a virtude de iluminar a questão da estabilidade atômica.constantes fundamentais: carga de elétrons, massa de elétrons, constante de Planck, permitividade de vácuo.
número quântico e fato de conversão entre metros e picômetros e joules e attojoules.esta figura mostra que a estabilidade atómica envolve um equilíbrio entre a energia potencial e a energia cinética., O elétron é atraído para o núcleo pela interação de energia potencial atrativa (~ -1 / R), mas é impedido de entrar em colapso no núcleo pela energia cinética extremamente grande (~1/R2) associada com pequenas órbitas.como mostrado abaixo, a abordagem gráfica também pode ser usada para encontrar os Estados eletrônicos excitados.
\
conforme mencionado anteriormente, a variedade de energias elétricas permitidas também pode ser obtida minimizando a energia em relação ao raio de órbita. Este procedimento produz,