A Relação entre Pressão e Volume: Lei de Boyle
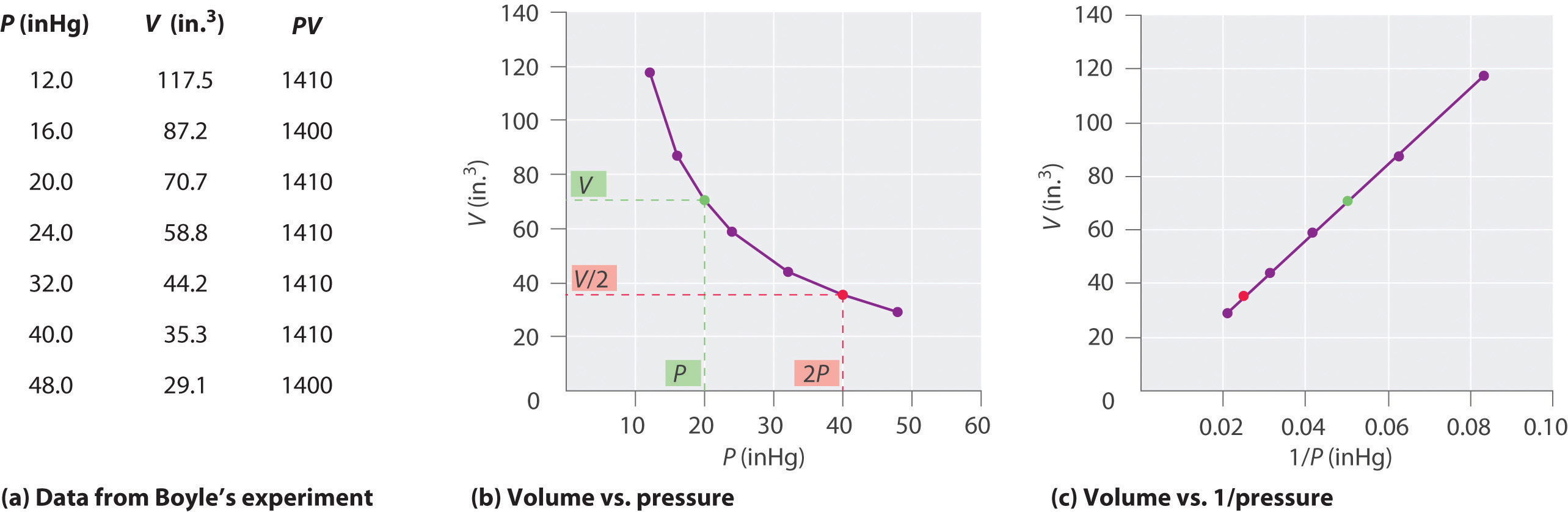
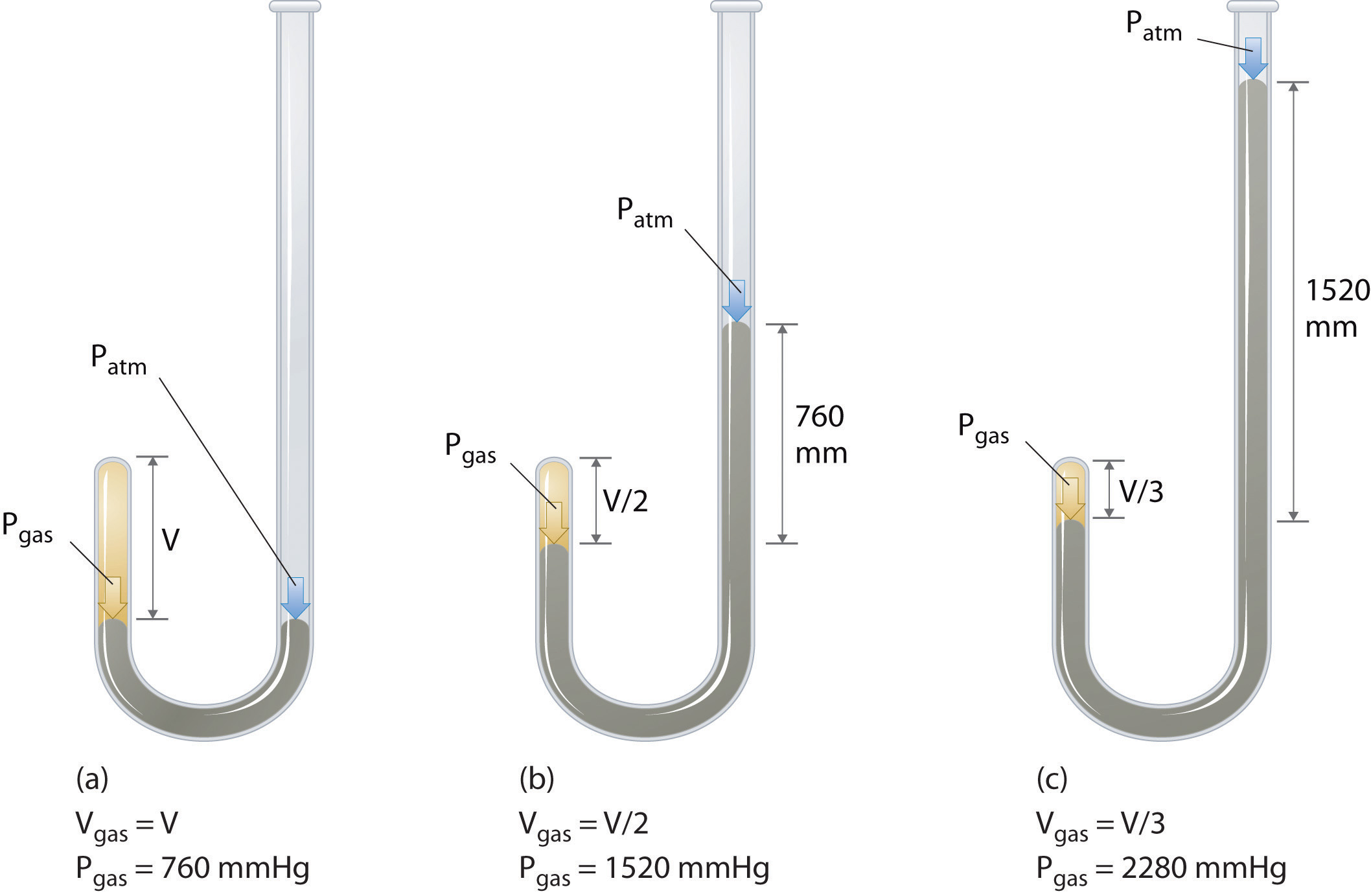
Como a pressão do gás aumenta, o volume do gás diminui porque as partículas de gás são forçados a aproximarem-se. Inversamente, como a pressão sobre um gás diminui, o volume do gás aumenta porque as partículas de gás podem agora mover-se mais longe., Balões meteorológicos ficam maiores à medida que sobem através da atmosfera para regiões de menor pressão porque o volume do gás aumentou; ou seja, o gás atmosférico exerce menos pressão sobre a superfície do balão, de modo que o gás interior se expande até que as pressões internas e externas sejam iguais.o químico irlandês Robert Boyle (1627-1691) realizou alguns dos primeiros experimentos que determinaram a relação quantitativa entre a pressão e o volume de um gás. Boyle usou um tubo em forma de J parcialmente cheio de mercúrio, como mostrado na figura \(\PageIndex{1}\)., Nestes experimentos, uma pequena quantidade de gás ou ar é presa acima da coluna de mercúrio, e seu volume é medido a pressão atmosférica e temperatura constante. Mais mercúrio é então derramado no braço aberto para aumentar a pressão sobre a amostra de gás. A pressão sobre o gás é a pressão atmosférica mais a diferença nas alturas das colunas de mercúrio, e o volume resultante é medido. Este processo é repetido até que não haja mais espaço no braço aberto ou o volume do gás é muito pequeno para ser medido com precisão., Dados como os de um dos experimentos de Boyle podem ser plotados de várias maneiras (figura \(\PageIndex{2}\)). Um gráfico simples de \(V\) versus \(P\) dá uma curva chamada hipérbole e revela uma relação inversa entre pressão e volume: à medida que a pressão é dobrada, o volume diminui por um fator de dois. Esta relação entre as duas grandezas é descrito da seguinte forma:
\
Dividindo ambos os lados por \(P\) fornece uma equação que ilustra a relação inversa entre \(P\) e \(V\):
\
ou
\
onde o ∝ símbolo é lido “é proporcional.”Um gráfico de V versus 1 / P é, portanto, uma linha reta cuja inclinação é igual à constante da equação 6.2.1 e da equação 6.2.3. Dividir ambos os lados da equação 6.2.1 por V em vez de P dá uma relação semelhante entre P E 1 / V., O valor numérico da constante depende da quantidade de gás utilizada na experiência e da temperatura a que as experiências são realizadas. Esta relação entre pressão e volume é conhecida como Lei de Boyle, depois de seu descobridor, e pode ser declarada da seguinte forma: a temperatura constante, o volume de uma quantidade fixa de um gás é inversamente proporcional à sua pressão.