Introdução
Elétrons têm nenhuma posição fixa em átomos, compostos e moléculas (ver imagem abaixo), mas têm probabilidades de serem encontrados em determinados espaços (orbitais). As formas de ressonância ilustram áreas de probabilidades mais elevadas (densidades elétricas). Isto é como segurar o chapéu na mão direita ou na esquerda. O termo ressonância é aplicado quando existem duas ou mais possibilidades disponíveis., Chemists use Lewis diagrams to depict structure and bonding of covalent entities, such as molecules and polyatomic ions, therefore, molecules. O diagrama de Lewis de muitas moléculas, no entanto, não é consistente com as propriedades observadas da molécula.o íon nitrato, de acordo com seu diagrama de Lewis, tem dois tipos de ligações nitrogênio-oxigênio, uma ligação dupla e duas ligações únicas, sugerindo que uma ligação Nitrogênio-Oxigênio no íon nitrato é mais curta e mais forte do que cada uma das outras duas., Além disso, a estrutura de Lewis implica, em relação à carga formal, que existem dois tipos de átomos de oxigênio no íon nitrato, um formalmente neutro e cada um dos outros dois carregando uma carga formal de -1. Experimentalmente, no entanto, as três ligações Nitrogênio-Oxigênio no íon nitrato têm o mesmo comprimento de ligação e a mesma energia de ligação, e os três átomos de oxigênio são indistinguíveis. The Lewis diagram fails to explain the structure and bonding of the nitrate ion satisfatoriamente.dois diagramas adicionais de Lewis podem ser desenhados para o íon nitrato.,
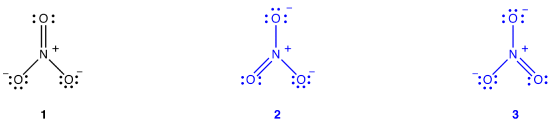
No entanto, nenhum deles é consistente com as propriedades observadas do íon nitrato e, portanto, não descreve corretamente o íon nitrato.
Exemplo de \(\PageIndex{2}\): Benzeno
o Benzeno, de acordo com o seu diagrama de Lewis, tem dois tipos de carbono-carbono títulos, três ligações duplas e três títulos, sugerindo que cada uma das três carbono-carbono títulos em benzeno é mais curto e mais forte do que cada um dos outros três. Experimentalmente, no entanto, as seis ligações carbono-carbono no benzeno têm o mesmo comprimento de ligação e a mesma energia de ligação., The Lewis diagram fails to explain the structure and bonding of benzene satisfatoriamente.
um atributo de moléculas das quais o diagrama de Lewis clássico não é consistente com as propriedades observadas é que outros diagramas de Lewis válidos podem ser gerados para elas. Um diagrama adicional de Lewis pode ser desenhado para benzeno.
No entanto, nenhum deles é consistente com as propriedades observadas do benzeno e, portanto, não representa corretamente o benzeno.,
A Teoria da ressonância é uma tentativa de explicar a estrutura de uma espécie, como o íon nitrato ou benzeno, sem Diagrama de Lewis do qual é consistente com as propriedades observadas da espécie. A principal vantagem da teoria da ressonância é que, embora baseada em análise matemática rigorosa, a teoria da ressonância pode ser aplicada com sucesso invocando pouca ou nenhuma matemática. A teoria da ressonância é explicada abaixo usando o íon nitrato como exemplo.de acordo com a teoria da ressonância, a estrutura do íon nitrato não é 1 Nem 2 nem 3, mas a média dos três, ponderada pela estabilidade., Os diagramas de Lewis 1, 2 e 3 são chamados de formas de ressonância, estruturas de ressonância ou contribuidores de ressonância do íon nitrato. A estrutura do íon nitrato é dito ser um híbrido de ressonância ou, simplesmente, híbrido de formas de ressonância 1, 2 e 3. Sempre que é necessário mostrar a estrutura do íon nitrato, as formas de ressonância 1, 2 e 3 são desenhadas, conectadas por uma seta de duas cabeças.,
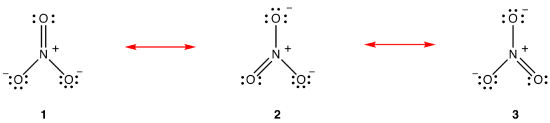
Os três ressonância formas de nitrato de íons de lítio, 1, 2, e 3 são idênticas, então eles têm a mesma estabilidade e, portanto, contribuem igualmente para o híbrido., Desde a exata medida em que cada um de ressonância forma de nitrato de íons contribui para o híbrido é conhecido, o vínculo, a fim de cada um de nitrogênio-oxigênio bond, bem como o formal de carga em cada átomo de oxigênio no híbrido pode ser facilmente determinada:
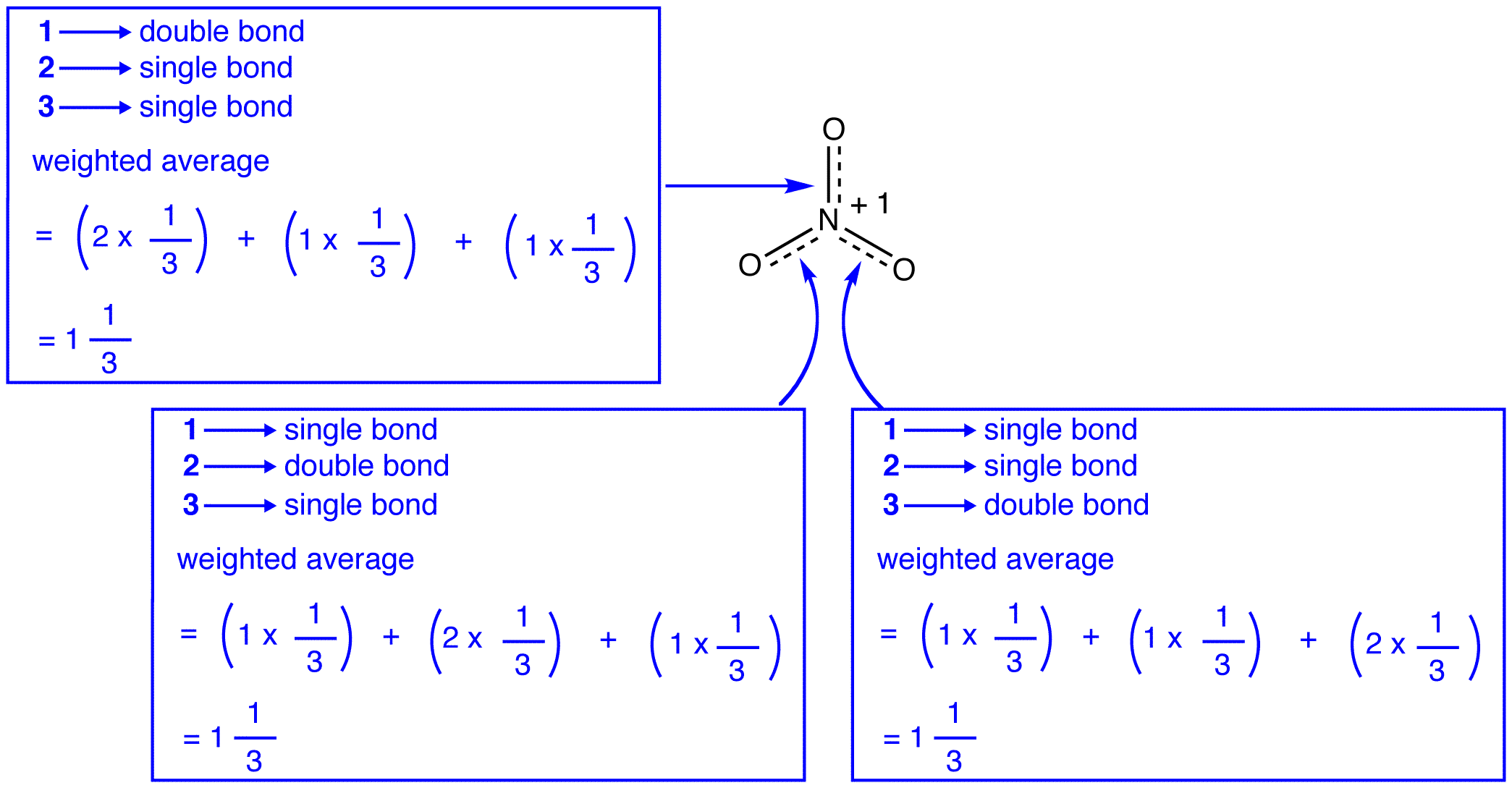
de Acordo com a teoria de ressonância, cada título do nitrato, íon é um e um terço de um vínculo, o que é consistente com a observação de que os três títulos do nitrato, íon tem o mesmo comprimento de ligação e a mesma energia de ligação.,
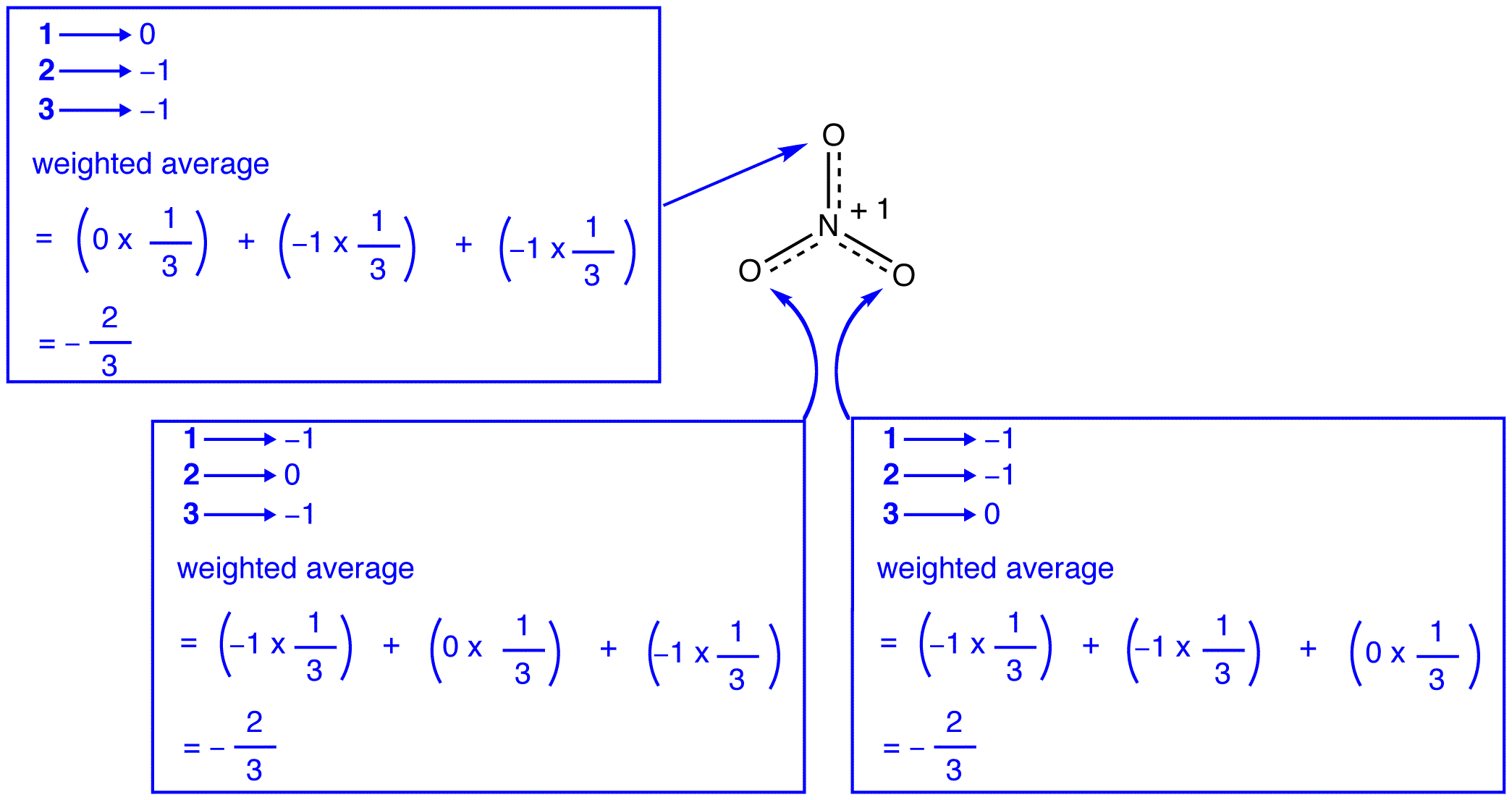
de Acordo com a teoria de ressonância, cada átomo de oxigênio do nitrato, íon tem uma carga formal de -2/3, que, em conjunto com o fato de que os três nitrogênio-oxigênio títulos são idênticos, é consistente com a observação de que os três átomos de oxigênio do nitrato de iões de são indistinguíveis. Em cada forma de ressonância do íon nitrato, há dois elétrons \(\pi\), e eles são compartilhados apenas por dois átomos. Um elétron compartilhado apenas por dois átomos é dito ser localizado., Assim, os dois elétrons \(\pi\) em cada forma de ressonância do íon nitrato são localizados. O nitrato de íons de lítio, como representado pela híbrido, tem dois \(\pi\) elétrons:
- # elétrons em um \(\pi\) bond = 2
- # elétrons em um terço de \(\pi\) bond = 2/3
- # elétrons em três deles = 3 x (2/3) = 2
Os dois \(\pi\) elétrons no nitrato de iões de são compartilhados por um total de quatro átomos, um átomo de nitrogênio e três átomos de oxigênio. Diz-se que um elétron compartilhado por mais de dois átomos é deslocalizado. Assim, os dois elétrons \(\pi\) no íon nitrato são deslocalizados., A deslocalização dos electrões \(\pi\) no íon nitrato requer que os quatro átomos estejam no mesmo plano, permitindo a sobreposição lateral dos orbitais p sobre eles.,

Se a energia do nitrato, íon foram a média ponderada das energias de seus três formas de ressonância, assim como a estrutura do nitrato, íon é a média ponderada das estruturas de suas três formas de ressonância, deve ser igual à energia de um dos três idênticos ressonância formas:

Se a energia do híbrido fosse igual ao de uma ressonância forma, dado que todas as substâncias químicas (partículas elementares, átomos, moléculas, etc., naturalmente tendem a estar no estado de energia mais baixo possível, não haveria nenhuma vantagem para o íon nitrato existir como o híbrido; poderia simplesmente existir como uma forma de ressonância. Uma vez que o íon nitrato existe como o híbrido, não como uma forma de ressonância, pode-se inferir que a energia do híbrido é menor do que a de qualquer uma das formas de ressonância.

de acordo com a teoria da ressonância, então, a energia de uma molécula é menor do que a da forma de ressonância de menor energia., Uma vez que o íon nitrato tem menor energia e, portanto, é mais estável do que qualquer uma de suas formas de ressonância, o íon nitrato é dito ser ressonância estabilizada.
equívocos comuns
Há dois equívocos sobre a teoria da ressonância entre os estudantes iniciantes, provavelmente devido à interpretação literal da palavra ressonância. Eles são descritos abaixo, usando o íon nitrato como exemplo.
equívoco 1: o íon nitrato existe como forma de ressonância 1 por um momento e então muda para a forma de ressonância 2 ou para a forma de ressonância 3, que interconverte, ou reverte para 1.,

a estrutura do ião nitrato não é 1 Nem 2 nem 3, mas o híbrido e não muda com o tempo, a menos que seja submetido a uma reacção.
equívoco 2: em uma amostra de íons nitratos, em um dado momento, um terço dos íons existem como forma de ressonância 1, outro terço como forma de ressonância 2, e o restante um terço como forma de ressonância 3.

numa amostra de íons nitratos, num dado momento, todos os íons têm a mesma estrutura, que é o híbrido.,
Mulas e Rinoceronte
O clássico analogia usada para esclarecer esses dois equívocos é a mula (Morrison, R. T.; Boyd, R.N. Química Orgânica, quinta edição; Allyn and Bacon: Boston, 1987, pg. 373). Biologicamente, uma mula é um híbrido de um cavalo e um burro. Isso não significa que uma mula se assemelha a um cavalo por um momento e, em seguida, muda para se assemelhar a um burro. A aparência de uma mula é uma combinação da de um cavalo e a de um burro e não muda com o tempo. Nem significa que, numa manada, algumas mulas se assemelham a um cavalo e as outras a um burro., Em uma manada, todas as mulas têm a mesma aparência, que é uma combinação de um cavalo e um burro. A fraqueza desta analogia é que cavalos e burros existem, enquanto as formas de ressonância são estritamente hipotéticas. Uma melhor analogia, citada em Morrison e Boyd, é o rinoceronte. Ao ver um rinoceronte, pode-se descrevê-lo como o híbrido de um dragão e um unicórnio, duas criaturas que não existem.