wprowadzenie
cukrzyca typu 2 (T2DM) charakteryzuje się insulinoopornością, która pozostaje stosunkowo stabilna przez cały okres choroby oraz postępującą utratą funkcji komórek β przy niewystarczającym wydzielaniu insuliny., Ze względu na postępującą ewolucję, większość pacjentów z T2DM będzie ostatecznie wymagać insuliny, aby osiągnąć i utrzymać kontrolę glikemii, stosując stopniowe podejście rozpoczynające się od insuliny podstawowej w połączeniu z lekami doustnymi. Gdy glikemia przed posiłkiem i po posiłku nie jest odpowiednio kontrolowana, zaleca się podawanie insuliny dwa razy na dobę z NPH (Neutral Protamine Hagedorn) lub mieszaniną preparatów insuliny., Podobnie jak u pacjentów z cukrzycą typu 1, leczenie insuliną w postaci bolusa powinno być wskazane u pacjentów z T2DM z ciężkim niedoborem insuliny, którzy nie są w stanie osiągnąć i utrzymać celów glikemicznych w schemacie dwa razy na dobę.Jednakże stosowanie tego schematu leczenia insuliną jest wyraźnie niewystarczające, prawdopodobnie ze względu na niechęć pacjentów i lekarzy ze względu na złożoność procesu jego tworzenia oraz ograniczone dostępne informacje na temat wykonalności, szczególnie u osób w podeszłym wieku, oraz jego skuteczności u pacjentów uprzednio leczonych dwiema dawkami insuliny.,2
w niniejszym badaniu oceniono wykonalność, skuteczność i bezpieczeństwo stosowania insuliny w bolusie u pacjentów z długotrwałą cukrzycą typu 2 i słabą lub niestabilną kontrolą glikemii.
materiał i metody
do tego prospektywnego, jednoośrodkowego badania włączono 37 pacjentów, którzy od października 2006 r. do października 2007 r. przeszli na schemat insuliny basal-bolus i mieli niestabilną lub słabą kontrolę glikemii (hemoglobina glikowana (HbA1c)≥8%) w ciągu ostatnich sześciu miesięcy, pomimo interwencji w celu jej poprawy., Protokół badania został zatwierdzony przez instytucjonalne Rady ds. oceny etycznej i uzyskano pisemną zgodę wszystkich pacjentów.
w początkowym okresie leczenia węglowodany były rozprowadzane w trzech głównych posiłkach. Początkową dawkę insuliny glargine obliczono jako 50% poprzedniej całkowitej dawki dobowej, a początkową insulinę pokarmową (aspart lub lispro) jako pozostałe 50% całkowitej dawki dobowej, podzielonej równo na trzy posiłki., Pacjenci, którzy przyjmowali metforminę przed zmianą leczenia i nie mieli do niej żadnych przeciwwskazań, kontynuowali stosowanie metforminy w tej samej dawce. Inne doustne leki przeciwcukrzycowe zostały przerwane.
wszyscy pacjenci uczestniczyli w zorganizowanym pozapartyjnym programie szkoleniowym z zakresu cukrzycy, składającym się z trzech 2-godzinnych sesji grupowych w ciągu tygodnia dla 5-8 pacjentów. Ogólnie rzecz biorąc, uczono ich przestrzegania diety zakładającej jakościowe spożycie węglowodanów w każdym posiłku, chociaż dla pacjentów, którzy chcieli ją zmienić, liczenie węglowodanów należało zrobić., Pacjenci dowiedzieli się również, jak stosować terapię basal-bolus i jak dostosowywać dawki insuliny bazowej zgodnie z samokontrolą glukozy we krwi na czczo (SMBG) co 7 dni. Dostosowanie dawki insuliny prandialnej przeprowadzono zgodnie z wartościami przed posiłkiem przy użyciu prostego algorytmu z ustalonymi dawkami szybko działającej insuliny. Pacjenci kontynuowali wizyty prowadzone przez pielęgniarkę w 1 i 3 tygodniu, 3 i 6 miesiącu oraz przez endokrynologa w 2, 4 i 7 miesiącu, gdzie sprawdzano dietę i sprawdzano dziennik z wartościami SMBG w celu dostosowania dawek insuliny., Dane antropometryczne (masa ciała, wskaźnik masy ciała i obwód talii), jak również zmienne dotyczące leczenia i biochemiczne zostały uzyskane przed rozpoczęciem leczenia oraz po 3 i 6 miesiącach u wszystkich pacjentów. Ilościowo określiliśmy zapotrzebowanie na insulinę i liczbę ciężkiej hipoglikemii (zdefiniowanej jako wymagająca pomocy) za pomocą wywiadu i przeglądu dzienników pacjentów.
HbA1c oznaczono za pomocą wysokosprawnej chromatografii cieczowej (HPLC) (Bio-Rad Laboratories, Monachium, Niemcy), z zakresem odniesienia 4,6-5,8%., Cholesterol i trójglicerydy oznaczono standaryzowanymi metodami enzymatycznymi, a cholesterol lipoprotein o wysokiej gęstości (HDLC) metodą bezpośrednią (Roche Diagnostics, Bazylea, Szwajcaria). Cholesterol lipoprotein o niskiej gęstości (LDLc) oceniano według wzoru Friedewalda (jeśli stężenie trójglicerydów wynosi
3,39 mmol/l) lub za pomocą ultracentryfugacji. Apolipoproteinę (Apo) B oznaczano metodą inmunoturbidymetryczną (Tina-quant, Roche Diagnostics), a wielkość LDL metodą elektroforezy (2-16%)., Jakość życia oceniano przy użyciu kwestionariusza specyficznego dla choroby, dostosowanego w Hiszpanii na podstawie oceny jakości życia w cukrzycy (DCCT) przed rozpoczęciem leczenia i powtarzano po 6 miesiącach od podania insuliny w bolusie.3,4
dane zostały przeanalizowane w programie statystycznym SPSS 15.0 (SPSS Inc.). Zmiany zmiennych antropometrycznych, HbA1c, zapotrzebowania na insulinę i profilu lipidowego oceniano metodą T testu Studenckiego. Uznano je za znaczące wartości p≤0,05.
wyniki
wyjściowe charakterystyki kliniczne przedstawiono w tabeli 1., Siedemdziesiąt osiem procent pacjentów było leczonych 2 dawkami NPH lub mieszankami insuliny, 11% pacjentów przyjmowało leki doustne i insulinę przed snem (glargine, detemir lub NPH), a pozostałe 11% pacjentów stosowało inne schematy leczenia z 3 dawkami NPH i insuliną zwykłą. 87% pacjentów miało stężenie HbA1c >8%, a 51% miało stężenie HbA1c>9%. Po przejściu na leczenie w bolusie poziom HbA1c spadł z 9±1,2% do 8,1±1,2% (p
0,001) po 3 miesiącach i do 8,0±1,2% po 6 miesiącach (P0.001) (Tabela 1, ryc. 1)., Odsetek pacjentów z HbA1c≥9% spadł z początkowego 51% (19 pacjentów) do 13,8% i 18,9%, odpowiednio po 3 i 6 miesiącach. Rys. 2 pokazuje odsetek pacjentów z hba1c7%, 7-8% i >8% przed i po zmianie leczenia na bolus basal. U pięciu pacjentów stwierdzono pogorszenie wartości HbA1c. Odnotowano tylko jeden epizod ciężkiej hipoglikemii. Po 6 miesiącach wszyscy pacjenci byli w stanie dostosować dawkę insuliny podstawowej, ale tylko 10 pacjentów zmodyfikowało dawkę posiłkową zgodnie ze schematem SMBG w sposób autonomiczny.,
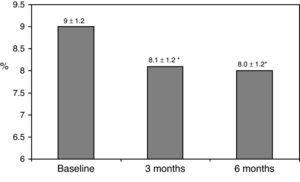
Glycated hemoglobin at baseline and 3 and 6 months after switching to basal-bolus regimen. *p0.001 compared to baseline. HbA1c: glycated hemoglobin.
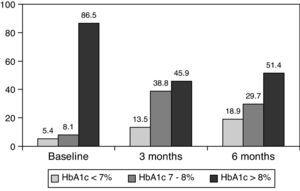
Percentage of patients with glycated hemoglobin 8% at baseline, and 3 and 6 months after switching to basal-bolus regimen.
masa ciała, zapotrzebowanie na insulinę i parametry lipidowe na początku leczenia oraz w czasie obserwacji przedstawiono w tabeli 1. Masa ciała pozostawała stabilna w ciągu 6 miesięcy obserwacji, a zapotrzebowanie na insulinę (J. M. / kg mc. / dobę) nie ulegało zmianie po 3 miesiącach i nieznacznie wzrosło po 6 miesiącach. Wielkość cząstek LDL wzrosła znacząco przy 3 (25,77±0,48 nm vs 25,98±0,5 nm, p0.05) i 6 miesiącach (25,77±0,48 nm vs 25,94±0,44 nm, p0.05), podczas gdy pozostałe parametry lipidowe nie uległy zmianie.,
dyskusja
w niniejszym badaniu pokazaliśmy, że terapia insuliną basal-bolus umożliwia poprawę kontroli glikemii bez uszczerbku dla bezpieczeństwa i jakości życia u pacjentów z długotrwałą cukrzycą typu 2, wcześniej leczonych jedną lub więcej dawkami insuliny. Wykazujemy również wykonalność wdrożenia tych schematów insuliny poprzez zorganizowany program szkolenia dla pacjentów.,
Consensus guidelines for the management of type 2 diabetes consider that the primary cels of treatment are to achieve HbA1c concesses as low as possible without causing acceptable hypoglycemia, especially in older patients or with coronary disease, and to prevent the development of microvascular and macrovascular complications.1,5 niestety, ostatnie badania wskazują, że duża część pacjentów z cukrzycą nie spełnia zalecanych celów glikemicznych.,6,7 chociaż w National Health and Nutrition Examination Survey (NHANES) odsetek pacjentów z HbA1c
7% wzrósł z 37% w latach 1999-2000 do 56,8% w latach 2003-2004, wskaźniki nieoptymalnej kontroli glikemii są szczególnie wysokie u osób o cechach podobnych do badanych przez nas, które od dawna chorują na cukrzycę lub leczenie insuliną.,6,7 dawkowanie dwa razy na dobę z NPH lub mieszaniną insuliny stosuje się w celu uproszczenia schematów insuliny, ale mają ograniczoną elastyczność, wymagają sztywnego przestrzegania regularnych posiłków, ograniczają możliwość dostosowania dawek poszczególnych składników i zwiększają możliwość hipoglikemii. Tak więc, chociaż wielu pacjentów początkowo osiągnie odpowiednią kontrolę glikemii za pomocą tego schematu, 8 gdy zdolność wydzielania insuliny komórek beta jest tracona, a niedobór insuliny jest poważny, kontrola glikemii staje się słaba i niestabilna, jak u większości pacjentów włączonych do niniejszego badania.,1,8 wykazano, że u pacjentów z długotrwałą cukrzycą typu 2, słabo kontrolowaną innymi schematami insuliny i niestabilnym profilem, schemat insuliny basal-bolus zmniejsza poziom HbA1c o jeden punkt w ciągu 6 miesięcy, a odsetek pacjentów z HbA1c≥9% z 51% do 14% po 3 miesiącach i 19% po 6 miesiącach. Dzieje się tak prawdopodobnie dlatego, że jest to terapia bardziej fizjologiczna; podczas gdy insulina prandial zastępuje endogenne wydzielanie insuliny w pierwszej fazie, insulina podstawowa zmniejsza poziom hiperglikemii na czczo., Tak więc, oprócz poziomu HbA1c 9 sposób intensywnego leczenia znacznie zmienia względny udział hiperglikemii podstawowej i poposiłkowej w ogólnej hiperglikemii pacjentów T2DM. Ostatnio Riddle et al.10 wykazały, że po intensyfikacji leczenia insuliną udział hiperglikemii podstawowej spada, ale nadal stanowi około jedną trzecią pozostałej hiperglikemii. W związku z tym, zgodnie z wynikami niniejszego badania, stosowanie schematów insuliny łączących insulinę podstawową z insuliną prandial będzie często potrzebne do osiągnięcia celów glikemicznych., W rzeczywistości wyniki te są zgodne z obszernymi dowodami na korzyści płynące ze stosowania dawki wstępnej w bolusie u pacjentów z cukrzycą typu 11 i są poparte ograniczonymi danymi z badań obserwacyjnych u pacjentów z cukrzycą typu 2, którzy przeszli ze schematu 12,13 opartego na premiksach do schematu 12,13 opartego na glarginie w bolusie oraz randomizowanym porównaniem schematu opartego na premiksach do schematu podstawowego w bolusie u pacjentów z cukrzycą typu 2.2,14,15 u pacjentów wcześniej leczonych glargine w skojarzeniu z doustnymi lekami przeciwcukrzycowymi różnica w HbA1c wynosiła 0.,22% na korzyść schematu bazowego-bolus glargine, w porównaniu do schematu zawierającego mieszaninę insulin15. W badaniu PREFER, 14 podgrupa pacjentów wcześniej leczonych insuliną podstawową wykazywała większe zmniejszenie HbA1c po zastosowaniu produktu detemir / aspart w schemacie basal-bolus w porównaniu z dwufazową insuliną aspart (-1, 21% vs -0, 75%). Wreszcie, w premiks leczonych pacjentów z cukrzycą typu 2, Fritsche et al. wykazano, że schemat oparty na glarginie w bolusie i glulizynie był lepszy od schematu zawierającego insulinę wstępną pod względem redukcji HbA1c (-1, 31% vs 0, 8%).,Dlatego też, chociaż istnieją różnice w wielkości poprawy między badaniami, prawdopodobnie ze względu na różne cechy wyjściowe badanej populacji, wydaje się, że wykazano wyższość schematu basal-bolus u wybranych pacjentów z długotrwałą chorobą. Zmniejszenie wartości HbA1c o więcej niż jeden punkt, uzyskane po zmianie schematu na insulinę basal-bolus, można uznać za istotne klinicznie, ponieważ może to prowadzić do zmniejszenia wyników klinicznych., Niestety, terapia basal-bolus jest niedostatecznie stosowana u pacjentów z T2DM, ponieważ lekarze uważają, że jest to skomplikowane do wdrożenia, jest czasochłonne i istnieją obawy o zwiększoną liczbę zastrzyków, ryzyko hipoglikemii, przyrost masy ciała i pogorszenie jakości życia. W tym i w poprzednich badaniach masa ciała i częstość występowania ciężkiej hipoglikemii nie wzrosły, 2,12, co może być związane z bardziej fizjologiczną substytucją insuliny za pomocą schematu basal-bolus i elastycznością, jaką może zaoferować ta terapia pacjentom., Tak więc strach przed hipoglikemią nie powinien być barierą do rozpoczęcia tego rodzaju terapii w T2DM, ale należy go wziąć pod uwagę w celu ustalenia celów kontroli glikemii, ponieważ może to powodować zachorowalność i zwiększoną śmiertelność.16 w odniesieniu do wpływu na jakość życia, zgodnie ze sprawozdaniem Ménard et al., 17 nasze badanie nie poparło poglądu, że schematy basal-bolus prowadzą do obniżenia jakości życia.
zgodnie z poprzednim raportem, 12 W obecnym badaniu wszyscy pacjenci byli w stanie dobrać dawkę insuliny podstawowej zgodnie z SMBG na czczo z ostatnich 3-7 dni., Natomiast niewielu pacjentów było w stanie dostosować dawki insuliny zgodnie ze schematami SMBG i najbardziej potrzebowali wsparcia prostego algorytmu z ustaloną dawką w zależności od poziomu glukozy we krwi przedmałżeńskiej. Nie jest to zaskakujące, ponieważ ustalenie optymalnej dawki insuliny w czasie posiłku często wiąże się z obliczeniami uwzględniającymi wiele czynników i jest trudne dla niektórych pacjentów. Co więcej, stosowanie prostego algorytmu do dostosowywania insuliny szybko działającej w czasie posiłku w każdym tygodniu w oparciu o wzorce SMBG jest tak samo skuteczne, jak dostosowanie insuliny w czasie posiłku za pomocą stosunku insuliny do węglowodanów u osób T2DM.,18
Ograniczenia badania są związane z prospektywnym projektem obserwacyjnym i brakiem grupy kontrolnej. Te aspekty i krótki obserwacji pacjentów, trudne do zinterpretowania ustaleń i ich przydatności do pacjentów z T2DM następnie w innych ośrodkach. Jednakże, chociaż w celu potwierdzenia tych wyników należy przeprowadzić przyszłe badania na większych grupach pacjentów, badanie dostarcza informacji, które mogą być przydatne w leczeniu częstej i słabo leczonej sytuacji klinicznej.,
podsumowując, niniejsze badanie wykazało, że 9-godzinny program leczenia poza pacjentem umożliwił pacjentom z długotrwałym T2DM, słabo kontrolowanym za pomocą innych schematów insuliny, przejście na schemat insuliny basal-bolus. Potwierdziliśmy również, że schemat insuliny basal-bolus jest skuteczny, bezpieczny i nie zmienia jakości życia w tej podgrupie pacjentów z T2DM. W związku z tym leczenie basal-bolus może być oferowane osobom z T2DM, które nie są wystarczająco kontrolowane za pomocą innych strategii insulinowych.
Irene Vinagre otrzymała wynagrodzenie za wykłady od Eli Lilly, Novo Nordisk i Sanofi Aventis., Antonio Perez otrzymał honoraria i wykłady od Eli Lilly, Novo Nordisk i Sanofi Aventis.