wyjątek 2: niekompletne oktety
drugi wyjątek od reguły oktetu jest wtedy, gdy jest zbyt mało elektronów walencyjnych, co skutkuje niekompletnym Oktetem. Jest jeszcze więcej przypadków, w których reguła oktetu nie daje najbardziej poprawnego przedstawienia cząsteczki lub jonu. Tak jest również w przypadku oktetów niekompletnych. Gatunki z niepełnymi oktetami są dość rzadkie i na ogół występują tylko w niektórych związkach berylu, glinu i boru, w tym wodorkach boru., Przyjrzyjmy się jednemu z takich wodorków, \(BH_3\) (boran).
Jeśli ktoś miałby stworzyć strukturę Lewisa dla \(BH_3\) zgodnie z podstawowymi strategiami rysowania struktur Lewisa, prawdopodobnie wymyśliłby tę strukturę (Rysunek 3):
problem z tą strukturą polega na tym, że BOR ma niekompletny oktet; ma tylko sześć elektronów wokół siebie., Atomy wodoru mogą naturalnie mieć tylko 2 elektrony w swojej zewnętrznej powłoce (ich Wersja oktetu) i jako takie nie ma zapasowych elektronów, aby utworzyć podwójne wiązanie z borem. Można przypuszczać, że niepowodzenie tej struktury w formowaniu oktetów kompletnych musi oznaczać, że Wiązanie to powinno być jonowe, a nie kowalencyjne., Jednak BOR ma bardzo podobną do wodoru elektroujemność, co oznacza, że w wiązaniach wodoru do boru jest prawdopodobnie bardzo mało jonowego charakteru i jako taka struktura Lewisa, choć nie spełnia zasady oktetu, jest prawdopodobnie najlepszą strukturą możliwą do zobrazowania BH3 z teorią Lewisa. Jedną z rzeczy, które mogą tłumaczyć niekompletny oktet BH3, jest to, że jest to gatunek przejściowy, utworzony tymczasowo w reakcjach obejmujących wiele etapów.
przyjrzyjmy się innej niekompletnej sytuacji oktetowej zajmującej się borem, BF3 (trifluorina boru)., Podobnie jak w przypadku BH3, początkowy rysunek struktury Lewisa BF3 utworzy strukturę, w której BOR ma wokół siebie tylko sześć elektronów (Rysunek 4).
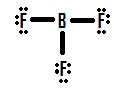
Jeśli spojrzysz na rysunek 4, zobaczysz, że atomy fluoru posiadają dodatkowe pary, których mogą używać do tworzenia dodatkowych wiązań z borem, i możesz pomyśleć, że wszystkie trzeba zrobić jedną samotną parę w więź i struktura będzie poprawna., Jeśli dodamy jedno wiązanie podwójne między borem a jedną z fluorów, otrzymamy następującą strukturę Lewisa (Rysunek 5):
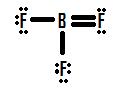
każdy fluor ma osiem elektronów, a ATOM boru ma też osiem! Każdy atom ma doskonały oktet, prawda? Nie tak szybko. Musimy zbadać formalne zarzuty tej struktury. Fluor, który dzieli wiązanie podwójne z borem, ma sześć elektronów wokół niego (cztery z dwóch samotnych par elektronów i po jednym z dwóch wiązań z borem)., Jest to o jeden elektron mniej niż liczba elektronów walencyjnych, które miałby naturalnie (Grupa siedem pierwiastków ma siedem elektronów walencyjnych), więc ma ładunek formalny równy +1. Dwie mąki, które dzielą pojedyncze wiązania z borem, mają wokół siebie siedem elektronów (sześć z trzech samotnych par i jeden z pojedynczych wiązań z borem). Jest to taka sama ilość, jak liczba elektronów walencyjnych, które mają na własną rękę, więc oba mają formalny ładunek zerowy. W końcu BOR ma wokół siebie cztery elektrony (po jednym z każdego z czterech wiązań współdzielonych z fluorem)., Jest to o jeden elektron więcej niż liczba elektronów walencyjnych, które Bor miałby samodzielnie, a jako taki BOR ma ładunek formalny równy -1.
ta struktura jest poparta faktem, że doświadczalnie określona długość wiązania boru do fluoru w BF3 jest mniejsza niż to, co byłoby typowe dla pojedynczego wiązania (patrz kolejność wiązań i długości)., Struktura ta jest jednak sprzeczna z jedną z głównych zasad ładunków formalnych: ujemne ładunki formalne powinny znajdować się na bardziej elektronegatywnym atomie w wiązaniu, ale w strukturze przedstawionej na rysunku 5 dodatni ładunek formalny znajduje się na fluorze, który nie tylko jest najbardziej elektronegatywnym pierwiastkiem w strukturze, ale najbardziej elektronegatywnym pierwiastkiem w całym układzie okresowym (\(\chi=4.0\)). Z drugiej strony Bor, o znacznie niższej elektroujemności 2,0, ma ujemny ładunek formalny w tej strukturze., Ta formalna niezgodność ładunku i elektronegatywności sprawia, że ta podwójna struktura jest niemożliwa.
jednak duża różnica elektroujemności tutaj, w przeciwieństwie do BH3, oznacza znaczące wiązania polarne między borem i fluorem, co oznacza, że cząsteczka ta ma wysoki charakter jonowy. Sugeruje to możliwość stworzenia półjonowej struktury, takiej jak na rysunku 6:

żadna z tych trzech struktur nie jest „poprawną” strukturą w tym przypadku., Najbardziej” poprawna ” struktura jest najprawdopodobniej rezonansem wszystkich trzech struktur: tej z niekompletnym oktetem (ryc. 4), tej z wiązaniem podwójnym (ryc. 5) i tej z wiązaniem jonowym (ryc. 6). Najbardziej przyczyniającą się strukturą jest prawdopodobnie niekompletna struktura oktetu (ponieważ rysunek 5 jest zasadniczo niemożliwy, a Rysunek 6 nie pasuje do zachowania i właściwości BF3). Jak widać, nawet jeśli istnieją inne możliwości, niekompletne oktety mogą najlepiej przedstawiać strukturę molekularną.,
na marginesie ważne jest, aby pamiętać, że BF3 często wiąże się z F – Jonem w celu utworzenia BF4 – zamiast pozostać jako BF3. Struktura ta dopełnia oktet boru i jest bardziej powszechna w przyrodzie. Świadczy to o tym, że oktety niekompletne są rzadkie, a inne konfiguracje są zazwyczaj korzystniejsze, w tym wiązanie z dodatkowymi jonami, jak w przypadku BF3 .
przykład: \(BF_3\)
narysuj strukturę Lewisa dla trifluorku boru (BF3).
rozwiązanie
1. Dodaj elektrony (3*7) + 3 = 24
2., Draw connectivities:
3. Dodaj oktety do atomów zewnętrznych:
4. Dodaj dodatkowe elektrony (24-24=0) do atomu centralnego:
5. Czy centralny elektron ma oktet?
- nie Ma 6 elektronów
- Dodaj Wiązanie wielokrotne (wiązanie podwójne), aby sprawdzić, czy ATOM centralny może osiągnąć oktet:
6. Centralny BOR ma teraz oktet (byłyby trzy struktury rezonansowe)
jednak…,
- w tej strukturze z wiązaniem podwójnym atom fluoru dzieli dodatkowe elektrony z borem.
- fluor miałby ładunek częściowy’+', a BOR ' – ' ładunek częściowy, jest to niespójne z elektroenergetycznością fluoru i boru.
- tak więc struktura BF3 z pojedynczymi wiązaniami i 6 elektronami walencyjnymi wokół centralnego boru jest najbardziej prawdopodobną strukturą
- BF3 reaguje silnie ze związkami, które mają nie podzieloną parę elektronów, które mogą być użyte do utworzenia wiązania z borem: