teoria brønsteda-Lowry 'ego kwasów i zasad
teoria brønsteda-Lowry' ego kwasów i zasad posunęła definicję Arrheniusa o krok dalej, ponieważ substancja nie musi już składać się z jonów wodoru (H+) lub wodorotlenku (OH -), aby zostać sklasyfikowana jako kwas lub zasada. Dla exmapl rozważmy następujące równanie chemiczne:
\
- kwas Brønsted-Lowry jest dawcą protonu (jonu wodorowego).
- baza Brønsteda-Lowry ' ego jest akceptorem protonów (jonów wodorowych).,
w tej teorii kwas jest substancją, która może uwolnić proton (jak w teorii Arrheniusa), a zasada jest substancją, która może przyjąć proton., Sól zasadowa, taka jak na+F-, wytwarza jony OH – w wodzie poprzez pobranie protonów z samej wody (w celu wytworzenia HF):
\
- dysocjacja kwasu
\
- dysocjacja zasadowa:
- stała jonizacji Zasady
- A oznacza H, tworząc HZ+.
- z przyjmuje H od A, które tworzy HZ+
- A-staje się sprzężoną bazą HA, a w reakcji odwrotnej przyjmuje H od HZ do odtworzenia HA, aby pozostać w równowadze
- HZ+ staje się sprzężonym kwasem Z, a w reakcji odwrotnej przekazuje H Do a – odtworzenia Z, aby pozostać w równowadze
\} {}\]
\
p>
\} {}\]
oznaczenie substancji jako kwasu lub zasady brønsted-Lowery ' ego można wykonać tylko obserwując reakcję. W przypadku HOH jest to zasada w pierwszym przypadku i kwas w drugim przypadku.,
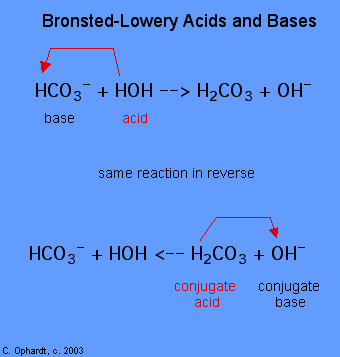
aby określić, czy substancja jest kwasem, czy zasadą, policz hydrogeny na każdej substancji przed i po reakcji. Jeśli liczba hydrogenów zmniejszyła się, to substancją jest kwas (oddaje jony wodorowe). Jeżeli liczba hydrogenów zwiększyła się, to substancją zasadową (przyjmuje jony wodorowe) jest substancja. Definicje te są zwykle stosowane do reagentów po lewej stronie. Jeśli reakcja jest oglądana w odwrotnej kolejności, można zidentyfikować nowy kwas i zasadę., Substancje po prawej stronie równania nazywane są sprzężonym kwasem i sprzężoną zasadą w porównaniu z tymi po lewej stronie. Należy również zauważyć, że oryginalny kwas zamienia się w sprzężonej zasadzie po zakończeniu reakcji.
Uwaga
kwasy są dawcami protonów, a zasady są akceptorami protonów
aby reakcja była w równowadze, musi nastąpić transfer elektronów. Kwas wyda elektron, a zasada otrzyma elektron. Kwasy i zasady, które współpracują ze sobą w ten sposób, nazywane są parą sprzężoną złożoną z sprzężonych kwasów i sprzężonych zasad.,
\
a oznacza związek kwaśny, A Z oznacza związek zasadowy