cele nauki
- zdefiniować korozję
- wymienić niektóre metody stosowane w celu zapobiegania lub spowolnienia korozji
korozja jest zwykle definiowana jako degradacja metali spowodowana przez korozję.proces elektrochemiczny. Powstawanie rdzy na żelazie, matowienie na srebrze i niebiesko-zielona patyna, która rozwija się na miedzi są przykładami korozji., Całkowity koszt korozji w Stanach Zjednoczonych jest znaczny, z szacunkami przekraczającymi pół biliona dolarów rocznie.
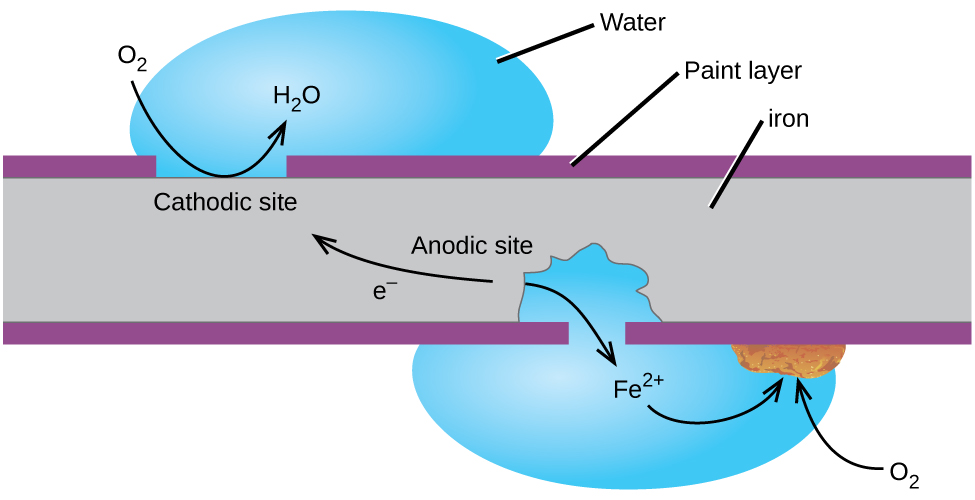
prawdopodobnie najbardziej znanym przykładem korozji jest powstawanie rdzy na żelazie. Żelazo rdzewieje, gdy jest wystawione na działanie tlenu i wody. Główne etapy rdzewienia żelaza wydają się obejmować następujące (Rysunek 2). Po wystawieniu na działanie atmosfery żelazo szybko utlenia się.
elektrony redukują tlen w powietrzu w roztworach kwaśnych.
to, co nazywamy rdzą, to uwodniony tlenek żelaza (III), który powstaje, gdy jony żelaza(II) reagują dalej z tlenem.,
liczba cząsteczek wody jest zmienna, więc jest reprezentowana przez x. w przeciwieństwie do patyny na miedzi, powstawanie rdzy nie tworzy warstwy ochronnej, a więc korozja żelaza trwa, ponieważ rdza odpada i naraża świeże żelazo na działanie atmosfery.
jednym ze sposobów na zapobieganie korozji żelaza jest jego malowanie. Warstwa farby zapobiega kontaktowi wody i tlenu niezbędnego do powstawania rdzy z żelazem. Dopóki farba pozostaje nienaruszona, żelazo jest chronione przed korozją.,
inne strategie obejmują stopowanie żelaza z innymi metalami. Na przykład stal nierdzewna to głównie żelazo z odrobiną chromu. Chrom ma tendencję do gromadzenia się w pobliżu powierzchni, gdzie tworzy warstwę tlenku, która chroni żelazo.
ocynkowane lub ocynkowane żelazo stosuje inną strategię. Cynk jest łatwiej utleniony niż żelazo, ponieważ cynk ma niższy potencjał redukcji. Ponieważ cynk ma niższy potencjał redukcji, jest bardziej aktywnym metalem. Tak więc, nawet jeśli powłoka cynkowa jest porysowana, cynk nadal utlenia się przed żelazem., Sugeruje to, że takie podejście powinno działać z innymi aktywnymi metalami.
innym ważnym sposobem ochrony metalu jest uczynienie go katodą w ogniwie galwanicznym. Jest to ochrona katodowa i może być stosowana do metali innych niż tylko żelazo. Na przykład rdzewienie podziemnych zbiorników i rur żelaznych można zapobiec lub znacznie ograniczyć, łącząc je z bardziej aktywnym metalem, takim jak cynk lub magnez (ryc. 3). Służy to również do ochrony metalowych części w podgrzewaczach wody., Bardziej aktywne metale (niższy potencjał redukcji) nazywane są anodami ofiarnymi, ponieważ w miarę ich zużycia korodują (utleniają się) na anodzie. Metal, który jest chroniony, służy jako katoda, a więc nie utlenia się (nie koroduje). Gdy Anody są odpowiednio monitorowane i okresowo wymieniane, żywotność zasobnika żelaza może być znacznie wydłużona.
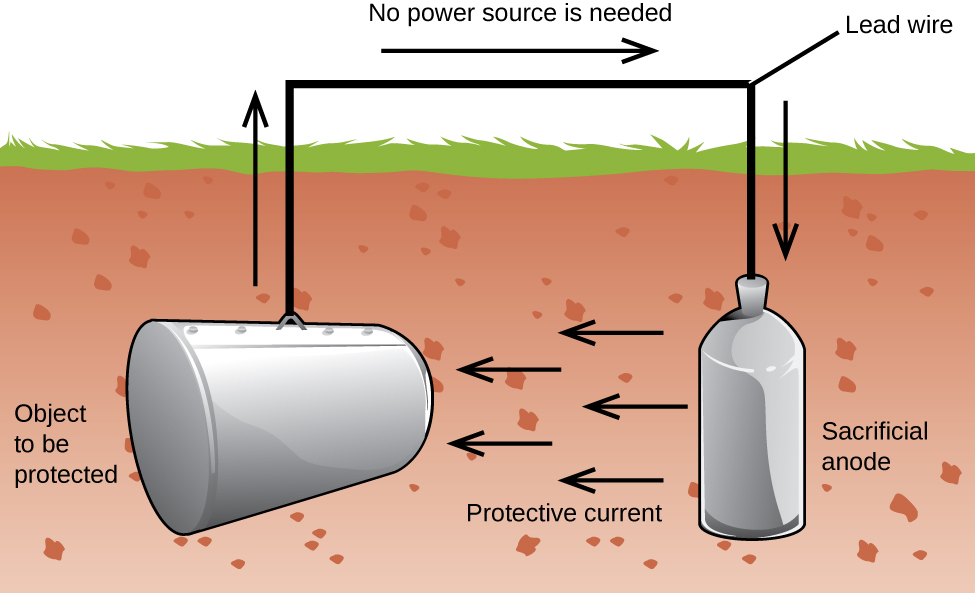
korozja to degradacja metalu spowodowana procesem elektrochemicznym. Każdego roku wydaje się duże sumy pieniędzy na naprawę skutków korozji lub zapobieganie jej. Niektóre metale, takie jak aluminium i miedź, wytwarzają warstwę ochronną, gdy korodują w powietrzu., Cienka warstwa tworząca się na powierzchni metalu zapobiega kontaktowi tlenu z większą liczbą atomów metalu, a tym samym „chroni” pozostały metal przed dalszą korozją. Żelazo koroduje (tworzy rdzę) pod wpływem wody i tlenu. Rdza, która powstaje na żelaznym metalu, odpada, odsłaniając świeży metal, który również koroduje. Jednym ze sposobów zapobiegania lub powolnej korozji jest powlekanie metalu. Powłoka zapobiega kontaktowi wody i tlenu z metalem. Farby lub inne powłoki spowolnią korozję, ale nie są skuteczne po zarysowaniu., Ocynkowane lub ocynkowane żelazo wykorzystuje fakt, że cynk jest bardziej podatny na utlenianie niż żelazo. Dopóki powłoka pozostaje, nawet jeśli porysowana, cynk utlenia się przed żelazem. Inną metodą ochrony metali jest ochrona katodowa. W tej metodzie łatwo utleniony i niedrogi metal, często cynk lub magnez (anoda ofiarna), jest elektrycznie połączony z metalem, który musi być chroniony. Bardziej aktywny metal jest anodą ofiarną i jest anodą w ogniwie galwanicznym. „Chroniony” metal jest katodą i pozostaje nieutleniony., Zaletą ochrony katodowej jest to, że anoda ofiarna może być monitorowana i wymieniana w razie potrzeby.,
Słowniczek
metoda ochrony katodowej ochrony metalu za pomocą anody ofiarnej i skutecznie czyni metal, który wymaga ochrony katody, zapobiegając w ten sposób jej utlenianiu korozji metalu za pomocą procesu elektrochemicznego ocynkowane żelazo metoda ochrony żelaza poprzez pokrycie go cynkiem, który utlenia się przed żelazem; ocynkowane żelazo anoda ofiarna bardziej aktywny, niedrogi metal stosowany jako anoda w ochronie katodowej; często wykonane z magnezu lub cynku
roztwory
odpowiedzi do chemii koniec rozdziału ćwiczenia
2., Mg i Zn
4. Oba przykłady obejmują ochronę katodową. Anoda jest metalem, który koroduje (utlenia się lub reaguje). W przypadku żelaza (-0,447 V) i cynku (-0,7618 V) cynk ma bardziej ujemny standardowy Potencjał Redukcji i dlatego służy jako anoda. W przypadku żelaza i miedzi (0,34 V), żelazo ma mniejszy standardowy potencjał redukcji, a więc koroduje (służy jako anoda).
6., Podczas gdy potencjał redukcji litu czyniłby go zdolnym do ochrony innych metali, ten wysoki potencjał wskazuje również na to, jak reaktywny jest lit; miałby spontaniczną reakcję z większością substancji. Oznacza to, że lit reagowałby szybko z innymi substancjami, nawet tymi, które nie utleniałyby metalu, który próbuje chronić. Taka reaktywność oznacza, że anoda uległaby szybkiemu wyczerpaniu i musiałaby być często wymieniana. (Opcjonalnie dodatkowy powód: zagrożenie pożarowe w obecności wody.)