the 1913 Bohr model of the hydrogen atom was replaced by Schrodingerʹs wave mechanical model in 1926. Jednak Model Bohrʹs jest nadal opłacalnie nauczany dzisiaj ze względu na jego konceptualną i matematyczną prostotę oraz ponieważ wprowadził szereg kluczowych kwantowych idei mechanicznych, takich jak liczba kwantowa, kwantyzacja obserwowalnych właściwości, skok kwantowy i stan stacjonarny.,
Bohr obliczył kolektor dozwolonych energii elektronów równoważąc siły mechaniczne (dośrodkowe i elektron‐jądro) na elektron wykonujący kołową orbitę o promieniu r wokół jądra, a następnie arbitralnie kwantyzując jego moment pędu. W końcu Fiata oświadczył, że elektron znajduje się w nie promieniującym stanie stacjonarnym, ponieważ orbitujący (przyspieszający) ładunek wypromieniowuje energię i zapadnie się w przeciwstawnie naładowane jądro.,
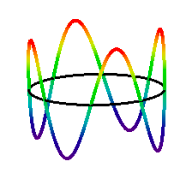
w 1924 roku de Broglie postulował dualność falowo‐cząsteczkową dla elektronu i innych masywnych cząstek, dając tym samym możliwość usunięcia części arbitralności z modelu Bohra. Na przykład elektron posiadający właściwości falowe podlega konstruktywnej i destrukcyjnej interferencji. Jak zostanie pokazane, prowadzi to naturalnie do kwantyzacji pędu elektronu i energii kinetycznej, a co za tym idzie, wielorakiego dozwolonego stanu energii dla elektronu w stosunku do jądra., Przedstawiony tu model De Broglie-Bohra atomu wodoru traktuje elektron jako cząstkę na pierścieniu o właściwościach falopodobnych.
\
hipoteza de Broglie ' a mówiąca, że materia ma właściwości falopodobne.
\
konsekwencja hipotezy de Broglie ' ego; integralna liczba długości fal musi mieścić się w obwodzie orbity. Wprowadza to liczbę kwantową, która może mieć wartości 1,2,3,… Stan elektronów n = 4 przedstawiono poniżej.,
\
zastąpienie pierwszego równania drugim równaniem ujawnia, że pęd jest kwantyzowany.
\
Jeśli pęd jest skwantowany, to energia kinetyczna.
\
co oznacza, że energia całkowita jest kwantyzowana. Drugim terminem jest elektron-proton elektrostatyczna energia potencjalna.
kwantowa mechaniczna interpretacja tych orbitalibobohrʺ jest taka, że są one Stanami stacjonarnymi. Pomimo tego, że używamy wyrażenia energia kinetyczna, co implikuje ruch elektronów, nie ma ruchu., Elektron zajmuje orbitę jako fala cząsteczkowa, nie krąży wokół jądra. Gdyby orbitował w klasycznym sensie, promieniowałby energią i szybko zapadłby się w jądro. Oczywiście stabilność materii wymaga kwantowej mechanicznej wersji energii kinetycznej.
energia stanu naziemnego i promień orbity elektronu w atomie wodoru znajduje się poprzez wykreślenie energii jako funkcji promienia orbity. Stan uziemienia jest minimum w krzywej energii całkowitej., W naturalny sposób można uzyskać te same informacje, minimalizując energię w stosunku do promienia orbity. Jednak metoda graficzna ma zaletę oświetlania kwestii stabilności atomowej.
Stałe Podstawowe: ładunek elektronu, masa elektronu, stała Plancka, przenikalność próżni.
liczba kwantowa i fakt konwersji między licznikami i pikometrami oraz dżulami i attojoulami.
\
\
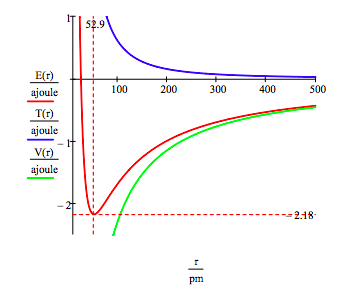
ten rysunek pokazuje, że stabilność atomowa obejmuje równowagę między energią potencjalną i kinetyczną., Elektron jest przyciągany do jądra przez atrakcyjne oddziaływanie energii potencjalnej (~-1 / R), ale zapobiega zapadaniu się do jądra przez niezwykle dużą energię kinetyczną (~1/R2) związaną z małymi orbitami.
jak pokazano poniżej, podejście graficzne może być również wykorzystane do znalezienia elektronicznych stanów wzbudzonych.
\
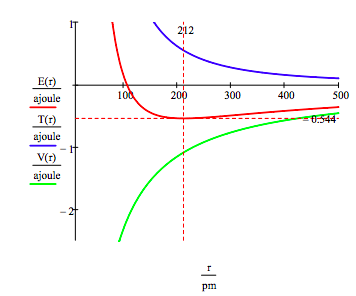
jak wspomniano wcześniej, kolektor dozwolonych energii elektronów można również uzyskać poprzez zminimalizowanie energii w odniesieniu do promienia orbity. Ta procedura daje,