zależność między ciśnieniem a objętością: prawo Boyle’a
wraz ze wzrostem ciśnienia na gaz, objętość gazu maleje, ponieważ cząstki gazu są wymuszane bliżej siebie. I odwrotnie, gdy ciśnienie na gaz spada, objętość gazu wzrasta, ponieważ cząstki gazu mogą teraz poruszać się dalej od siebie., Balony pogodowe stają się większe, gdy wznoszą się przez atmosferę do regionów o niższym ciśnieniu, ponieważ objętość gazu wzrosła; to znaczy, Gaz atmosferyczny wywiera mniejsze ciśnienie na powierzchnię balonu, więc Gaz wewnętrzny rozszerza się, aż ciśnienie wewnętrzne i zewnętrzne są równe.
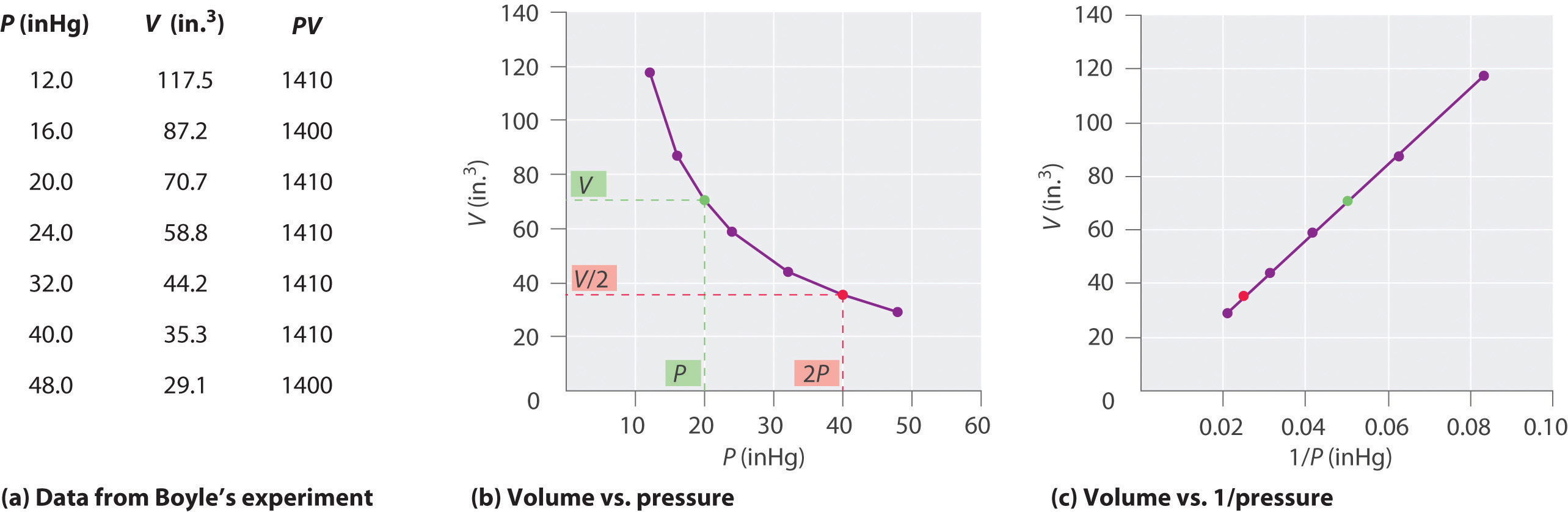
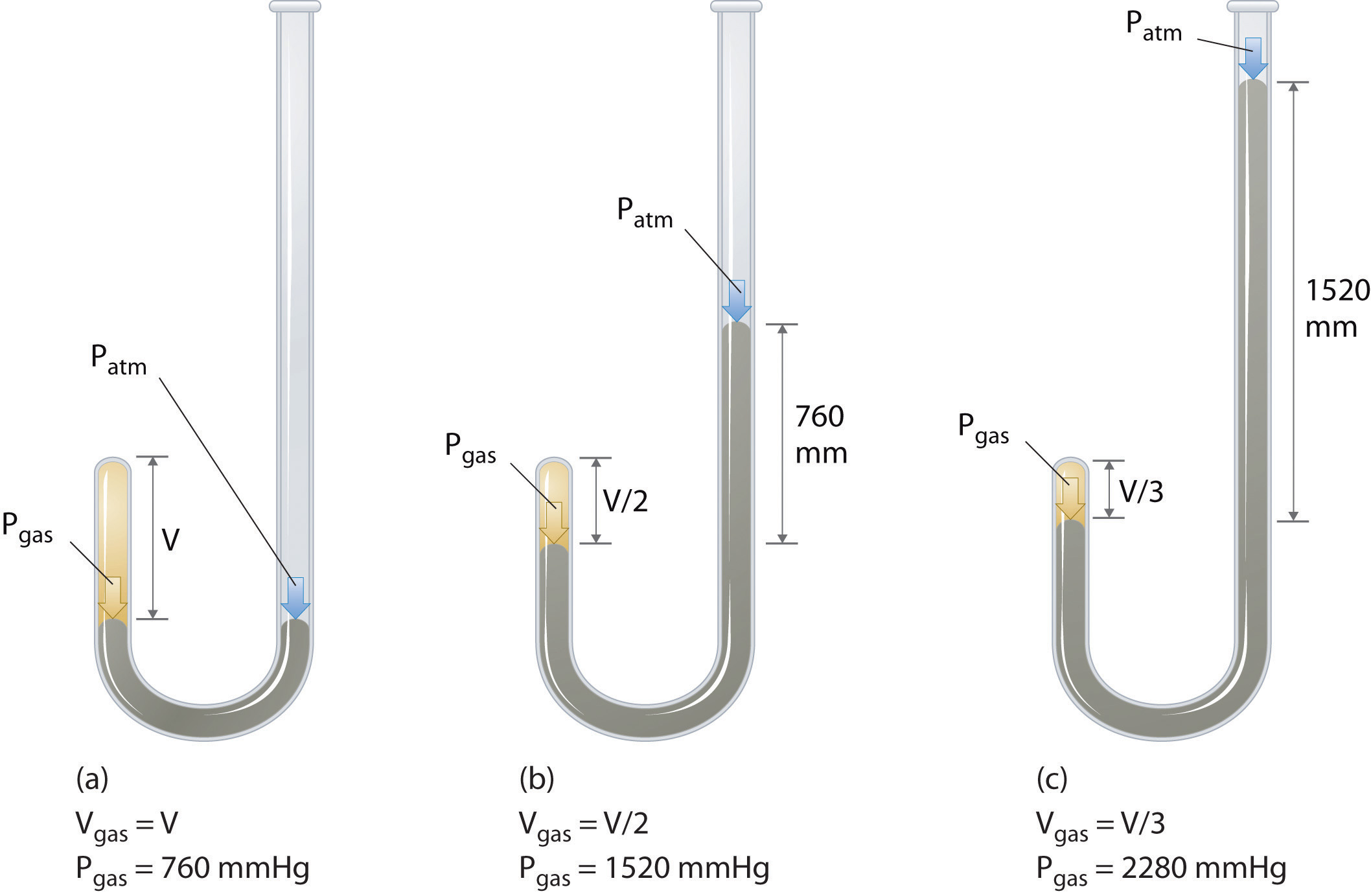
Irlandzki chemik Robert Boyle (1627-1691) przeprowadził jedne z najwcześniejszych eksperymentów, które określiły ilościowy związek między ciśnieniem a objętością gazu. Boyle użył rury w kształcie litery J, częściowo wypełnionej rtęcią, jak pokazano na rysunku \(\PageIndex{1}\)., W tych eksperymentach niewielka ilość gazu lub powietrza jest uwięziona nad kolumną rtęci, a jego objętość jest mierzona przy ciśnieniu atmosferycznym i stałej temperaturze. Następnie do otwartego ramienia wlewa się więcej rtęci, aby zwiększyć ciśnienie na próbce gazu. Ciśnienie na gaz jest ciśnieniem atmosferycznym plus różnica wysokości kolumn rtęci, a wynikająca z tego objętość jest mierzona. Proces ten powtarza się, dopóki w otwartym ramieniu nie ma już miejsca lub objętość gazu jest zbyt mała, aby można ją było dokładnie zmierzyć., Dane takie jak te z jednego z własnych eksperymentów Boyle ' a mogą być wykreślone na kilka sposobów (rysunek \(\PageIndex{2}\)). Prosty wykres \(V\) versus \ (P\) daje krzywą zwaną hiperbolą i ujawnia odwrotną zależność między ciśnieniem a objętością: gdy ciśnienie jest podwojone, objętość maleje o współczynnik dwa. Zależność ta jest opisana w następujący sposób:
\
dzielenie obu stron przez \(P\) daje równanie ilustrujące odwrotną zależność między \(P\) I \(V\):
\
lub
\
gdzie symbol ∝ jest odczytany „jest proporcjonalny do.”Wykres V kontra 1 / P jest więc linią prostą, której nachylenie jest równe stałej w równaniu 6.2.1 i równaniu 6.2.3. Dzielenie obu stron równania 6.2.1 przez V zamiast P daje podobną zależność między P I 1 / V., Wartość liczbowa stałej zależy od ilości gazu użytego w eksperymencie i od temperatury, w której eksperymenty są przeprowadzane. Zależność między ciśnieniem a objętością jest znana jako prawo Boyle ' a, po jego odkrywcy i można ją określić następująco: w stałej temperaturze objętość stałej ilości gazu jest odwrotnie proporcjonalna do jego ciśnienia.