dobrym przykładem lipidów niepolarnych jest tłuszcz obojętny tristearynian glicerolu. Ta najpopularniejsza forma tłuszczu zwierzęcego służy jako magazyn energii i jako izolacja przed utratą ciepła. Na poziomie molekularnym jest on zbudowany z trzech cząsteczek kwasu stearynowego i jednej glicerolu:
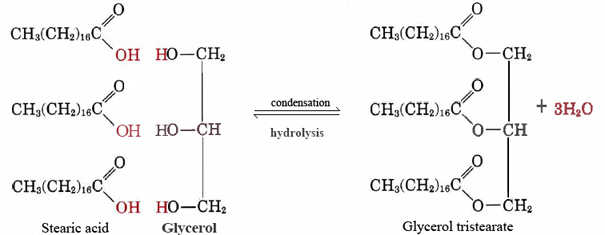 (1)
(1)
bardzo wiele nonpolarnych lipidów może być wytworzonych przez połączenie różnych długołańcuchowych kwasów z glicerolem., Ponieważ kwasy te pochodzą pierwotnie z tłuszczów, są one zbiorczo określane jako kwasy tłuszczowe.
zauważ, że dla każdej cząsteczki stearynowej lub innej cząsteczki kwasu tłuszczowego, która łączy się z jedną z grup —OH glicerolu, wydzielana jest cząsteczka wody, a więc reakcja jest kondensacją. Okazuje się, że wiele ważnych cząsteczek biologicznych powstaje w wyniku reakcji kondensacji, podczas której wydzielana jest woda. Rewers Eq. (1), w którym woda reaguje z dużą cząsteczką i dzieli ją na mniejsze kawałki, nazywa się hydrolizą., Poprzez przeprowadzenie hydrolizy organizmy żywe mogą rozkładać cząsteczki wytwarzane przez inne gatunki. Otrzymany w ten sposób prosty budulec może być następnie rekombinowany w wyniku reakcji kondensacji, tworząc struktury odpowiednie do nowego żywiciela.
w przeciwieństwie do tristearynianu glicerolu występującego u zwierząt, tłuszcze roślinne zawierają liczne podwójne wiązania w długich łańcuchach węglowodorowych. Ta wielonienasycenie wprowadza „załamania” w łańcuchach węglowodorowych ze względu na barierę dla obrotu i kąty 120° związane z podwójnymi wiązaniami., W związku z tym trudniej jest wyrównać łańcuchy obok siebie (patrz rysunek \(\PageIndex{1}\) ), a nienasycone tłuszcze nie pakują się tak łatwo w sieć krystaliczną. Podobnie jak w przypadku alkanów, Długość łańcucha określa również, czy tłuszcz jest ciekły czy stały i gdzie występuje temperatura topnienia.
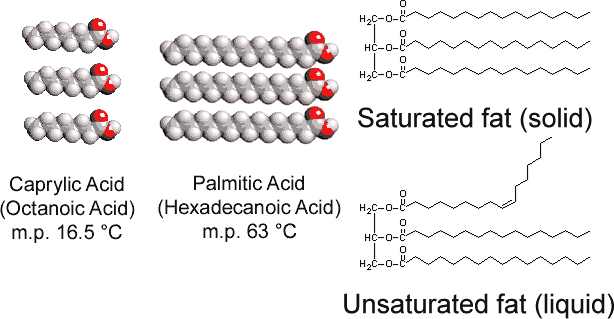
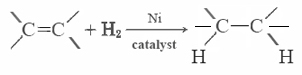
większość tłuszczów nienasyconych (takich jak olej kukurydziany) To ciecze w zwykłych temperaturach, podczas gdy tłuszcze nasycone (takie jak masło) to Ciała stałe. Oleje roślinne mogą być przekształcane przez uwodornienie do związków, które są substancjami stałymi. Proces ten polega na dodaniu katalitycznie H2 do wiązań podwójnych:
hydroliza tłuszczów jest ważna w produkcji mydeł., Może być przyspieszony przez dodanie silnej zasady, takiej jak NaOH lub KOH, w którym to przypadku reakcja nazywa się zmydleniem. Ponieważ zmydlanie wymaga wysokiego pH mieszaniny reakcyjnej, produkowany kwas tłuszczowy dysocjuje do anionu. Gdy tristearynian glicerolu zmydla się za pomocą NaOH, na przykład powstaje stearynian sodu, substancja stosunkowo rozpuszczalna w wodzie i powszechne mydło.
zdolność mydeł do czyszczenia smaru i oleju z zabrudzonych powierzchni jest wynikiem podwójnych struktur hydrofobowo-hydrofilowych ich cząsteczek., Na przykład jon stearynianowy składa się z długiego niepolarnego łańcucha węglowodorowego z wysoce polarną grupą COO na jednym końcu.
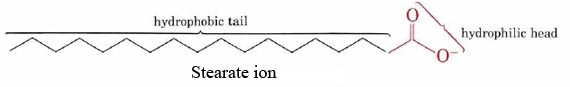
hydrofobowy łańcuch węglowodorowy stara się unikać kontaktu z mediami wodnymi, podczas gdy grupa anionowa łatwo przyjmuje atrakcje dipolowe i wiązania wodorowe cząsteczek wody.
dwa główne sposoby uniknięcia wody przez hydrofobowe porcje jonów stearynianowych to skupienie się na powierzchni lub rozpuszczenie w niewielkiej ilości oleju lub smaru (patrz rysunek \ (\PageIndex{2}\)).,
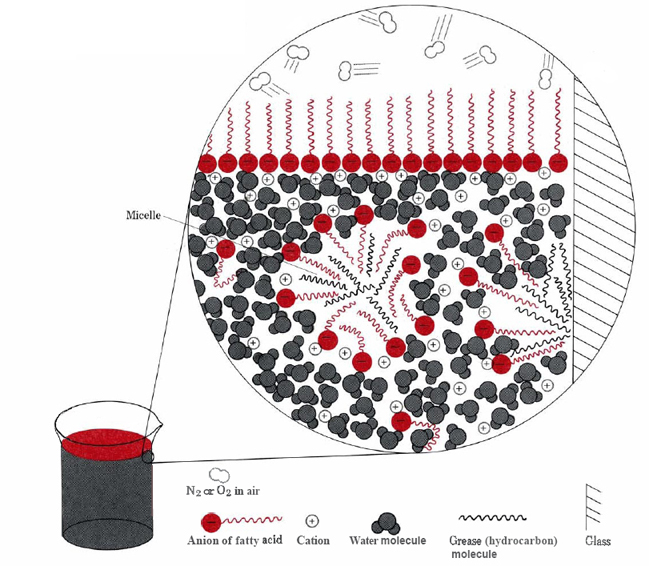
w tym drugim przypadku hydrofilowe głowice cząsteczek mydła stykają się z wodą Na Zewnątrz smaru, tworząc strukturę zwaną micelem. Ponieważ zewnętrzne strony Miceli są ujemnie naładowane, odpychają się nawzajem i zapobiegają rekombinacji kropel smaru., Dlatego smar jest zawieszony (emulgowany) w wodzie i można go łatwo zmyć.
naturalne mydła, takie jak stearynian sodu, były pierwotnie wytwarzane w domu przez podgrzewanie tłuszczu zwierzęcego popiołem drzewnym, który zawierał potaż, K2CO3. Duże ilości są nadal produkowane przemysłowo, ale w znacznym stopniu mydła zostały zastąpione detergentami. Jest to konsekwencja niepożądanego zachowania mydeł w twardej wodzie. Wapń, magnez i inne kationy twardej wody tworzą nierozpuszczalne związki w połączeniu z anionami kwasów tłuszczowych., Powoduje to wytrącanie się scummy i zapobiega emulgowaniu smaru przez cząsteczki mydła, chyba że użyto dużego nadmiaru.
detergenty takie jak alkilobenzenosulfoniany (ABS) i liniowe alkilobenzenosulfoniany (LAS) mają struktury bardzo podobne do stearynianu sodu, z tym że grupa naładowana w ich hydrofilowych głowicach jest —SO3– przyłączona do pierścienia benzenowego. Detergenty ABS mają również grupy metylowe (CH3) rozgałęziające się od łańcuchów węglowodorowych.,
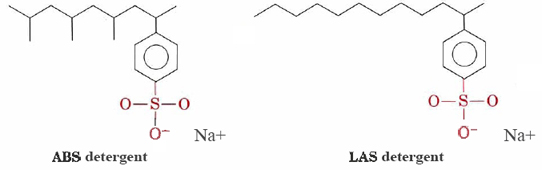
takie cząsteczki nie wytrącają się z kationami twardej wody i dlatego są bardziej odpowiednie do prania w pralce. Detergenty LAS zastąpiły ABS w połowie lat sześćdziesiątych, kiedy odkryto, że te ostatnie nie ulegają biodegradacji. Powodowały, że rzeki, a nawet woda z kranu, były pokryte detergentami i pianą. Najwyraźniej enzymy w mikroorganizmach, które ewoluowały w celu rozbicia niezrównoważonych łańcuchów węglowodorowych w naturalnych tłuszczach i kwasach tłuszczowych, nie były w stanie trawić rozgałęzionych łańcuchów cząsteczek ABS., Detergenty LAS, choć wytwarzane przez ludzi, naśladują struktury naturalnie występujących cząsteczek i ulegają biodegradacji.