wprowadzenie
elektrony nie mają ustalonej pozycji w atomach, związkach i cząsteczkach (patrz rysunek poniżej), ale mają prawdopodobieństwo znalezienia się w pewnych przestrzeniach (orbitalach). Formy rezonansowe ilustrują obszary o wyższym prawdopodobieństwie (gęstości elektronów). To jak trzymanie kapelusza w prawej lub lewej ręce. Termin rezonans jest stosowany, gdy dostępne są dwie lub więcej możliwości., Chemicy używają diagramów Lewisa do zobrazowania struktury i wiązania jednostek kowalencyjnych, takich jak cząsteczki i jony poliatomowe, odtąd cząsteczki. Diagram Lewisa wielu cząsteczek nie jest jednak zgodny z obserwowanymi właściwościami cząsteczki.
przykład \(\PageIndex{1}\): Jon azotanowy
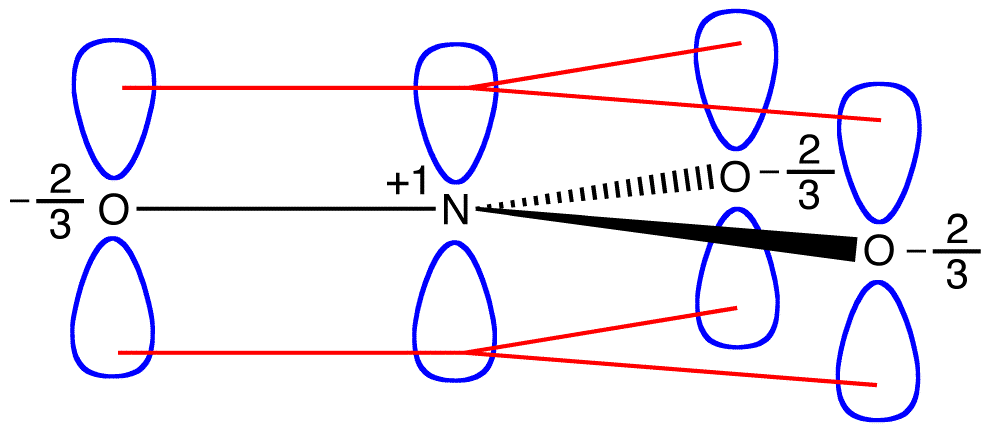
jon azotanowy, zgodnie z diagramem Lewisa, ma dwa rodzaje wiązań azotowo-tlenowych, jedno podwójne i dwa pojedyncze, co sugeruje, że jedno wiązanie azotowo-tlenowe w Jonie azotanowym jest krótsze i silniejsze niż każde z dwóch pozostałych., Ponadto struktura Lewisa zakłada, w odniesieniu do ładunku formalnego, że w Jonie azotanowym istnieją dwa typy atomów tlenu, jeden formalnie neutralny, a każdy z dwóch pozostałych nosi ładunek formalny równy -1. Eksperymentalnie jednak trzy wiązania azotowo-tlenowe w Jonie azotanowym mają tę samą długość wiązania i tę samą energię wiązania, a trzy atomy tlenu są nierozróżnialne. Diagram Lewisa nie wyjaśnia w sposób zadowalający struktury i wiązania jonu azotanowego.
można narysować dwa dodatkowe diagramy Lewisa dla jonu azotanowego.,
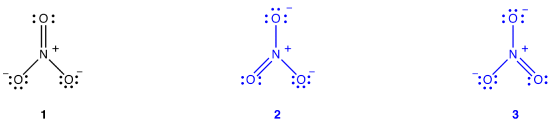
jednak żadna z nich nie jest zgodna z obserwowanymi właściwościami jonu azotanowego i dlatego nie przedstawia prawidłowo jonu azotanowego.
przykład \(\PageIndex{2}\): benzen
benzen, zgodnie z diagramem Lewisa, ma dwa rodzaje wiązań węgiel-węgiel, trzy podwójne i trzy pojedyncze, co sugeruje, że każde z trzech wiązań węgiel-węgiel w benzenie jest krótsze i silniejsze niż każde z pozostałych trzech. Eksperymentalnie jednak sześć wiązań węgiel-węgiel w benzenie ma taką samą długość wiązania i tę samą energię wiązania., Diagram Lewisa nie wyjaśnia w sposób zadowalający struktury i wiązania benzenu.
atrybutem cząsteczek, których klasyczny diagram Lewisa nie jest zgodny z obserwowanymi właściwościami jest to, że można dla nich wygenerować Inne ważne diagramy Lewisa. Dla benzenu można narysować jeden dodatkowy diagram Lewisa.

jednak żadna z nich nie jest zgodna z obserwowanymi właściwościami benzenu i dlatego nie przedstawia prawidłowo benzenu.,
Główną zaletą teorii rezonansu jest to, że chociaż opiera się na rygorystycznej analizie matematycznej, teoria rezonansu może być z powodzeniem zastosowana, odwołując się do małej lub żadnej matematyki. Teoria rezonansu jest wyjaśniona poniżej, używając jonu azotanowego jako przykładu.
zgodnie z teorią rezonansu, struktura jonu azotanowego nie jest 1, 2, 3, ale średnia wszystkich trzech z nich, ważona stabilnością., Diagramy Lewisa 1, 2 i 3 nazywane są formami rezonansowymi, strukturami rezonansowymi lub kontrybucjami rezonansowymi jonu azotanowego. O strukturze jonu azotanowego mówi się, że jest hybrydą rezonansową lub po prostu hybrydą form rezonansowych 1, 2 i 3. Ilekroć konieczne jest pokazanie struktury jonu azotanowego, rysuje się formy rezonansowe 1, 2 i 3, połączone strzałkami dwugłowymi.,
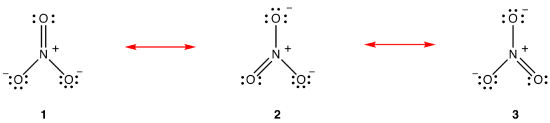
trzy formy rezonansowe jonu azotanowego, 1, 2 i 3, są identyczne, więc mają taką samą stabilność i dlatego w równym stopniu przyczyniają się do hybrydy., Ponieważ znany jest dokładny zakres, w jakim każda forma rezonansowa jonu azotanowego przyczynia się do hybrydy, kolejność wiązania każdego wiązania azot-tlen, jak również formalny ładunek na każdym atomie tlenu w hybrydzie, można łatwo określić:
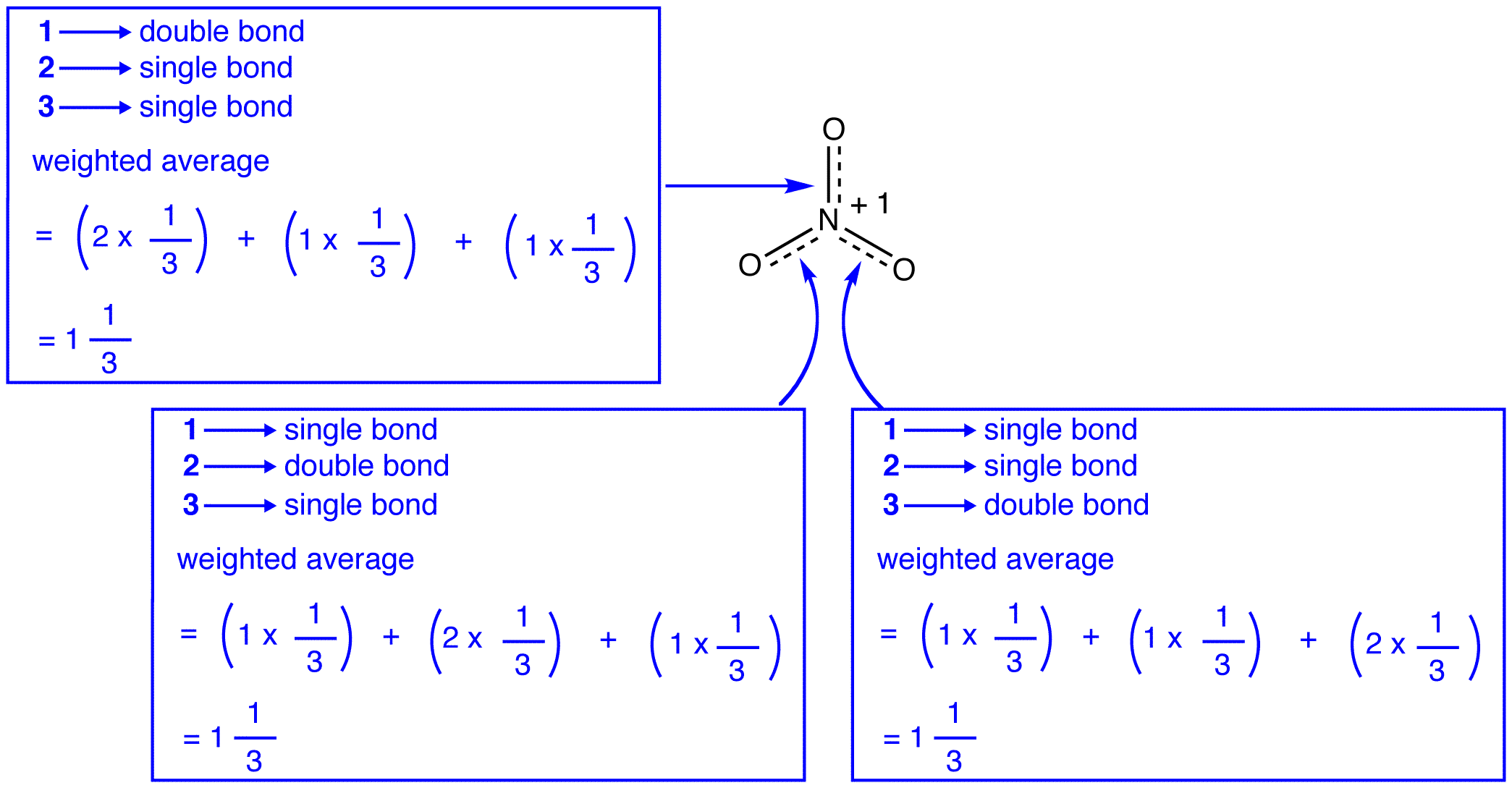
zgodnie z teorią rezonansu, każde Wiązanie w Jonie azotanowym stanowi jedną trzecią wiązania, co jest zgodne z obserwacją, że trzy wiązania w Jonie azotanowym mają tę samą długość wiązania, a wiązanie w Jonie azotanowym jest ta sama energia wiązania.,
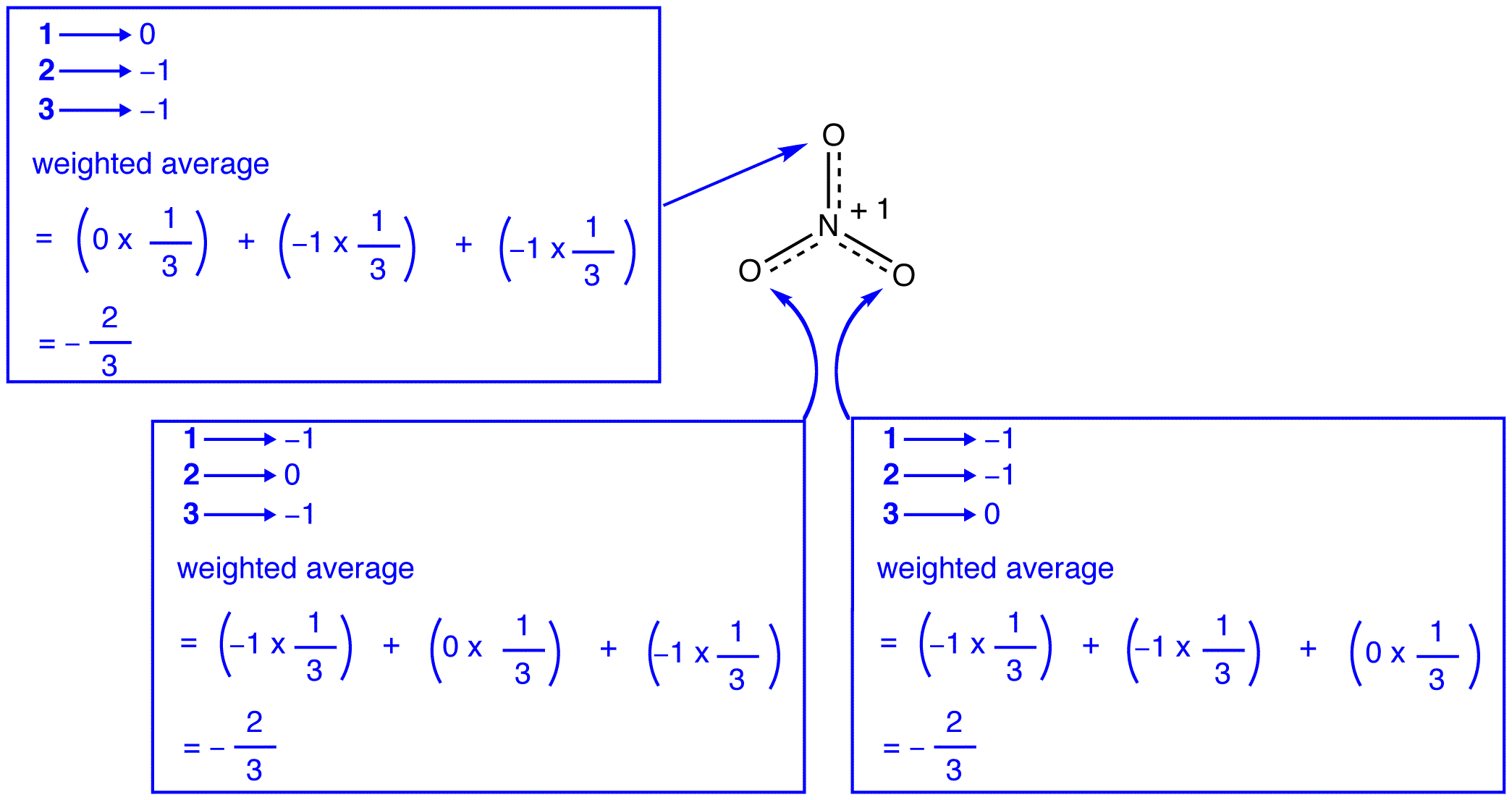
zgodnie z teorią rezonansu, każdy atom tlenu w Jonie azotanowym ma formalny ładunek -2/3, co w połączeniu z faktem, że trzy wiązania azot-tlen są identyczne, jest zgodne z obserwacją, że trzy atomy tlenu w Jonie azotanowym są nierozróżnialne. W każdej postaci rezonansowej jonu azotanowego znajdują się dwa elektrony \(\pi\) i są one dzielone tylko przez dwa atomy. Mówi się, że elektron dzielony tylko przez dwa atomy jest zlokalizowany., W ten sposób dwa\ (\pi\) elektrony w każdej postaci rezonansowej jonu azotanowego są zlokalizowane. Jon azotanowy, reprezentowany przez hybrydę, ma dwa \(\pi\) elektrony:
- # elektrony w jednym \(\pi\) wiązaniu = 2
- # elektrony w jednej trzeciej \(\pi\) wiązania = 2/3
- # elektrony w trzech z nich = 3 x (2/3) = 2
dwa \(\pi\) elektrony w Jonie azotanowym są wspólne przez łącznie cztery atomy, jeden z nich jest atom azotu i trzy atomy tlenu. Mówi się, że elektron dzielony przez więcej niż dwa atomy ulega delokalizacji. W ten sposób dwa \(\pi\) elektrony w Jonie azotanowym ulegają delokalizacji., Delokalizacja elektronów \(\pi\) w Jonie azotanowym wymaga, aby cztery atomy znajdowały się na tej samej płaszczyźnie, umożliwiając boczne nakładanie się na siebie orbitali P.,
Jeśli energia jonu azotanowego była średnią ważoną energii jego trzech form rezonansowych, tak jak struktura jonu azotanowego jest średnią ważoną struktur jego trzech form rezonansowych, powinna być równa energii jednej z trzech identycznych form rezonansowych:
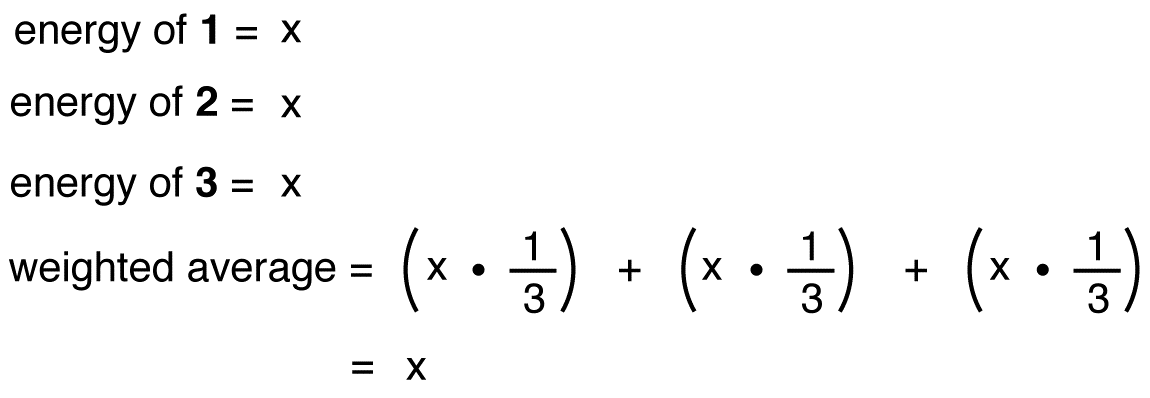
jeśli energia hybrydy była równa energii postaci rezonansowej, biorąc pod uwagę, że wszystkie jednostki chemiczne (cząstki elementarne, Atomy, cząsteczki itp.,) naturalnie wydają się być w najniższym możliwym stanie energetycznym, nie byłoby korzyści, aby jon azotanowy istniał jako hybryda; mógłby po prostu istnieć jako forma rezonansowa. Ponieważ jon azotanowy istnieje jako hybryda, a nie jako forma rezonansowa, można wywnioskować, że energia hybrydy jest niższa niż jakiejkolwiek formy rezonansowej.
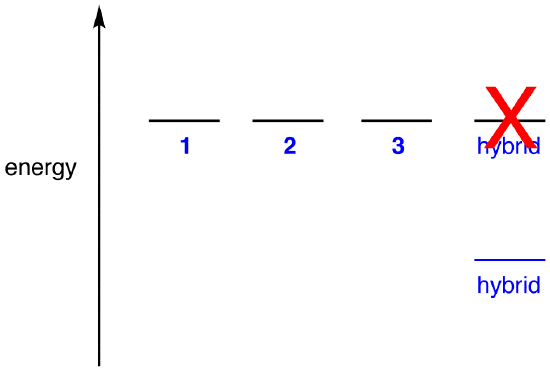
zgodnie z teorią rezonansu, energia cząsteczki jest niższa niż w postaci rezonansu o najniższej energii., Ponieważ jon azotanowy ma mniejszą energię, a zatem jest bardziej stabilny niż jakakolwiek jego forma rezonansowa, mówi się, że Jon azotanowy jest stabilizowany rezonansowo.
powszechne nieporozumienia
istnieją dwa błędne przekonania na temat teorii rezonansu wśród początkujących uczniów, prawdopodobnie z powodu dosłownej interpretacji słowa rezonans. Są one opisane poniżej, używając jonu azotanowego jako przykładu.
błąd 1: jon azotanowy istnieje przez chwilę jako forma rezonansowa 1, a następnie zmienia się w formę rezonansową 2 lub w formę rezonansową 3, która interkonwertuje lub powraca do 1.,
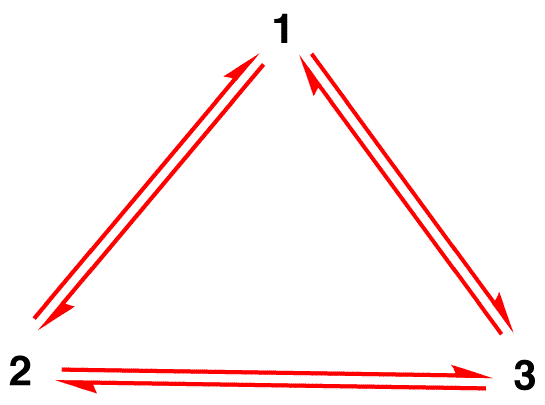
struktura jonu azotanowego nie jest 1 Ani 2 ani 3, ale hybrydowa i nie zmienia się z czasem, chyba że przechodzi reakcję.
błąd 2: w próbce jonów azotanowych w danym momencie jedna trzecia jonów występuje jako forma rezonansowa 1, kolejna jedna trzecia jako forma rezonansowa 2, a pozostała jedna trzecia jako forma rezonansowa 3.
w próbce jonów azotanowych w danym momencie wszystkie jony mają tę samą strukturę, która jest hybrydą.,
muły i nosorożce
klasyczną analogią używaną do wyjaśnienia tych dwóch nieporozumień jest muł (Morrison, R. T.; Boyd, R. N. Organic Chemistry, fifth edition; Allyn and Bacon: Boston, 1987, pg. 373). Biologicznie muł jest hybrydą konia i osła. Nie oznacza to, że muł przez chwilę przypomina konia, a następnie zmienia się w osła. Wygląd muła jest połączeniem wyglądu konia i osła i nie zmienia się z czasem. Nie oznacza to również, że w stadzie niektóre muły przypominają konia, a inne osła., W stadzie wszystkie muły mają ten sam wygląd, który jest połączeniem konia i osła. Słabością tej analogii jest to, że konie i osły istnieją, podczas gdy formy rezonansowe są ściśle hipotetyczne. Lepszą analogią, cytowaną przez Morrisona i Boyda, jest nosorożec. Widząc nosorożca, można opisać go jako hybrydę smoka i jednorożca, dwóch stworzeń, które nie istnieją.