Inleiding
kernfactor kappa B (NF-kB) is een oude eiwittranscriptiefactor (Salminen et al., 2008) en beschouwd als een regulator van aangeboren immuniteit (Baltimore, 2009). De NF-kB signalerende weg verbindt pathogene signalen en cellulaire gevaarsignalen waardoor cellulaire weerstand tegen binnenvallende ziekteverwekkers wordt georganiseerd., In feite, een overvloed van studies hebben aangetoond NF-kB is een netwerk hub verantwoordelijk voor complexe biologische signalering (Albensi and Mattson, 2000; Kaltschmidt and Kaltschmidt, 2009; Karin, 2009). Daartoe is NF-kB verondersteld een meester regulator te zijn van evolutionair geconserveerde biochemische cascades (Mattson et al., 2000). Andere factoren worden ook getransloceerd in de mitochondriën en zijn betrokken bij modulerende expressie (Barshad et al., 2018a), maar zijn niet de focus van deze review., Het doel van dit overzicht is om te proberen te begrijpen hoe NF-kB activiteit bijdraagt aan de mitochondriale functie. Aangenomen wordt dat de lezer al een begrip heeft van de fundamentele mitochondriale biologie. In het geval van verdere studie wordt de lezer verwezen naar vele uitstekende studies en recensies over mitochondriale structuur en functie (Hall, 1979; Fox, 1982; Roger and Silberman, 2002; Henze and Martin, 2003; Conradt, 2006; Ettema, 2016; Wang and Youle, 2016; Barshad et al., 2018b).,
NF-kB activering
subeenheden van de kernfactor kappa B, die het NF-kB-complex omvatten, worden uitgedrukt in zowel neuronen als glia. Het NF-kB complex bestaat in een inactieve toestand in het cytoplasma (Ghosh et al., 1998; Aggarwal et al., 2004; Hayden and Ghosh, 2004) waar de activering van NF-kB goed beschreven is (Li and Karin, 2000; Baud and Jacque, 2008; Israel, 2010). Wanneer gestimuleerd door moleculen zoals TNFa, of andere celstressoren, bindt TNFa aan TNF-receptoren (figuur 1)., Deze binding, via verschillende tussenstappen, leidt tot een interactie met het IKB kinase (IKK) complex, wat vervolgens leidt tot de fosforylering van ikb, en vervolgens resulteert in IKB ubiquitinatie en degradatie. Zodra gedegradeerd, transloceert het resterende dimeer van NF-kB (b. v., subeenheden van p65/p50) aan de kern, waar het aan de opeenvolging van de consensus van DNA van diverse doelgenen bindt. De selectiviteit van de NF-kB-respons is gebaseerd op verscheidene factoren (Sen en Smale, 2010) met inbegrip van dimeersamenstelling, timing, en celtype., De invloed van NF-kB op de overleving van cellen is ook complex en kan neuroprotectief of pro-inflammatoir zijn, afhankelijk van het celtype, ontwikkelingsstadium en pathologische toestand (Qin et al., 2007).
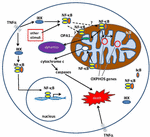
figuur 1. Wegen voor nucleaire factor κ B (NF-kB) signaleren in het cytoplasma en mitochondrion. Het NF-kB tri-subuntcomplex (bijvoorbeeld p65, p50, IKB – een mogelijke combinatie) bestaat in een inactieve toestand in het cytoplasma. De activering van NF-kB wordt geïnitieerd wanneer de molecules zoals TNFa aan TNF-receptoren binden (verschillende types bestaan)., Andere externe of interne stimuli kunnen ook NF-kB activeren. Een ingewikkeld signaaltransductie proces begint dan zodra TNF receptoren worden geactiveerd; IkB kinase (IKK) wordt uiteindelijk geactiveerd en leidt tot de fosforylatie van ikb, die in IKB ubiquitination en degradatie resulteert. Zodra IkB is gedegradeerd, transloceert het resterende NF-kB dimeer (b.v., P65/p50 of P50/p50 subeenheid combinaties zijn mogelijk) naar de kern, waar het bindt aan een DNA consensus sequentie van doelgenen., Door processen niet goed begrepen, kunnen de complexe NF-kB of NF-kB subeenheden ook migreren in mitochondrion, waar het bewijsmateriaal het voorstelt / zij de intermembrane ruimte bezet. Eenmaal binnen mitochondriën, wordt NF-kB verondersteld om met OXFOSGENEN (mitochondrial mtDNA) in wisselwerking te staan die tot de uitdrukking van proteã NEN betrokken bij diverse functies, met inbegrip van mitochondrial dynamica en COX III verordening (component van complexe IV) leidt., Het bewijsmateriaal suggereert ook, NF-kB kan als schakelaar in mitochondria functioneren en het evenwicht tussen het gebruik van cytoplasmic glycolyse en mitochondrial ademhaling in normale cellen en in kanker controleren. Tot slot wijzen de gegevens ook op intrinsieke apoptotic wegstimulatie, waar de activering van NF-kB in mitochondria tot cytochroom c versie leidt, waarbij caspase cascades en programmeerde celdood worden teweeggebracht.,
Organisatorisch, NF-kB is een Rel familie van de transcriptie factor en is geassocieerd met vijf genen, NF-kB1, NF-kB2, RELA, RELB, en REL (Chen en Greene, 2004); deze genen coderen voor verschillende eiwitten, NF-kB1, NF-kB2, RelA, RelB, en c-Rel, respectievelijk, waar twee van deze eiwitten zijn grote voorloper eiwitten bekend als p105 en p100 dat ondergaan proteolyse te worden p50 en p52, respectievelijk. Deze proteã nen bevatten rel-homologiedomeinen (RHD) bij hun amino-eindgebied; het gebied RHD is samengesteld uit 2 afzonderlijke, maar aangrenzende domeinen., De meest verre opeenvolging van het carboxy-eindgebied staat de proteã ne toe om aan DNA te binden. Een meer binnenlandse opeenvolging staat de rel-familieproteã nen toe om te dimeriseren (homo – of heterodimers) voor de afschaffing van uitdrukking via de band van hun overeenkomstige familie van inhibitors, de proteã nen van IkB (Chen en Greene, 2004). De laatste sequentie omvat de nuclear-localization sequence (NLS) die ontmaskerd wordt wanneer IkB niet gebonden is door degradatie. De NLS heeft de taak van het begeleiden of taggen van actieve eiwitten voor invoer in de celkern (Chen and Greene, 2004; Karin et al ., 2004; Barger et al.,, 2005).
drie van deze eiwitten (RelA, RelB en c-REL) coderen ook een transactivation domain (TADs) in hun carboxy-terminale regio. TADs staan deze proteã nen toe om met het basale transcriptieapparaat in wisselwerking te staan, als Tata bindende proteã ne (TBP), transcriptiefactor IIB, evenals de transcriptionele co-activators van het P300 en van het reactieelement van het kamp (CREB) bindende proteã ne (CBP) (Chen en Greene, 2004) wordt bekend., Slechts deze drie proteã nen kunnen transcriptie van hun DNA-codeert gebieden veroorzaken terwijl de andere proteã nen, P50 en P52 homodimers, de verbindingsplaatsen van DNA kunnen bezetten zonder transcriptie in werking te stellen. Gegeven dit, werken de latere 2 homodimers proteã nen van p50 en p52 als transcriptionele onderdrukkers (Chen en Greene, 2004).
De P105-en p100-homodimers bezetten DNA-bindingsplaatsen, waardoor transcriptie wordt geblokkeerd via transcriptiefactoren die TADs bezitten (Barger et al., 2005). Een derde vorm van transcriptionele onderdrukking is toe te schrijven aan IKB proteã nen., Deze proteã nen hebben verscheidene ankyrin herhalingen als hun kerndomein en functie door aan RHD te binden die NLS maskeren (Karin et al., 2004). Zonder actieve NLS, zijn de proteã nen NF-kB beperkt tot het cytoplasma en kunnen niet in de kern migreren en zo wordt de transcriptie geblokkeerd.
NF-kB wordt gevonden in de mitochondriën
in 2001, een studie van Bottero et al. (2001) vond IkBa en de NF-kB p65 subeenheid in subcellulaire fracties en gezuiverde mitochondria uit Jurkat cellen. Jurkat cellen zijn een vereeuwigde cellijn van menselijke T lymfocyten cellen die worden gebruikt om leukemie te bestuderen., In Bottero ‘ s studie werd vastgesteld dat IkBa en NF-kB p65 gelokaliseerd waren in de mitochondriale intermembrane ruimte. De mitochondriale intermembrane ruimte is de ruimte die bestaat tussen het binnenste mitochondriale membraan (IMM) en het buitenste mitochondriale membraan (OMM).
later, Cogswell et al. (2003) toonde ook aan dat NF-kB subeenheden, p50 en p65, en IkBa, werden gevonden in de mitochondriën. Om dit te bepalen, werden verscheidene methodes gebruikt om bewijsmateriaal, met inbegrip van elektronenmicroscopie van secties van u937 cellen te verstrekken., U937 cellen werden eerst geïsoleerd uit het lymfoom van een mannelijke patiënt van middelbare leeftijd om het gedrag en de differentiatie van monocyten te bestuderen. Hier Cogswell et al. (2003) was in staat om NF-kB P50 en P65 subeenheden en IkBa te visualiseren in de binnenste matrix van de mitochondriën. In dit onderzoek werden ook levercellen van ratten onderzocht en de subeenheid p50 en de subeenheid IkBa werden ook geïdentificeerd. Bovendien werden u937 cellen gedurende 1 uur gestimuleerd met TNFa, een bekende trigger van de NF-kB signalerende weg., In dit experiment, Western blot analyses in mitochondriale en cytoplasmatische fracties gevonden dat TNFa behandeling veroorzaakte een verlies van IkBa in zowel mitochondriale en cytoplasmic compartimenten door 30 min na behandeling suggereert dat IkBa was gedegradeerd. EMSA-analyse, een in vitro-analyse die NF-kB-activering en niet-specifieke binding aan DNA-sequenties detecteert, werd ook uitgevoerd op eiwit uit nucleaire extracten van mitochondriën geïsoleerd uit U937 cellen gestimuleerd met TNFa., Hier bepaalden zij TNFa het signaleren leidde tot verhoogde de bindende activiteit van DNA van NF-kB p50, in proteã ne uit mitochondria wordt genomen.
andere studies hebben ook NF-kB in de mitochondriën gedetecteerd. Deze omvatten studies (Guseva et al., 2004; Zamora et al., 2004) in menselijke fibroblast HT1080 cellijnen, menselijke prostaat LNCaP en PC3 cellijnen, en HeLa cellen. In LNCaP cellen, werden mitochondria NF-kB p50 en P65 subeenheden gevonden gebonden aan mitochondrial DNA (mtDNA)., Samen genomen, tonen deze studies bewijs voor NF-kB signalering in de mitochondriën en dat NF-kB mitochondriale mRNA expressie reguleert (zie NF-kB en mitochondriale genexpressie sectie hieronder).
NF-kB controleert de mitochondriale Dynamica
Er zijn verschillende eiwitten betrokken bij de dynamica (kernsplijting en fusie) en morfologie van de mitochondriën (Karbowski and Youle, 2003; Olichon et al., 2006; Brooks and Dong, 2007; Song et al., 2008; Autret and Martin, 2010; Silva et al., 2013; Sinha en Manoj, 2019). Een daarvan is het optisch atrofie-1-eiwit (OPA1) (Olichon et al.,, 2006; Garcia et al., 2018; Lee and Yoon, 2018). Studies hebben gesuggereerd dat OPA1 is een regulator van mitochondriale binnenste membraan fusie en ook mitochondriale cristae remodellering (Cipolat et al., 2006). Onlangs Laforge et al. (2016) toonde aan dat de afwezigheid van IKKa een impact had op OPA1 expressie in de mitochondriën en op mitochondriale morfologie.
verrassend genoeg, in een recente studie door Nan et al. (2017), werd de stimulatie van TNFa receptor 2 (TNFR2) gevonden om mitochondrial fusie via de NF-kB-afhankelijke activering van OPA1 uitdrukking in hart myocytes te bevorderen., Belangrijk is dat TNFR2-activering in deze studie cardiale myocyten beschermde tegen stress door OPA1-expressie op te heffen. Door het toedienen van lage concentraties exogeen TNFa (0,5 ng/mL) vóór ischemie-reperfusie bleek de celoverleving te verbeteren, terwijl hogere concentraties (10-20 ng/mL) leidden tot toxische effecten in cellen.
NF-kB en apoptose in de mitochondriën
De rol van mitochondriën in programed celdood, of apoptose is al geruime tijd bekend (Green and Reed, 1998; Wang and Chen, 2015)., De belangrijkste rol voor mitochondria is de generatie van ATP; nochtans, is de tweede belangrijkste functie voor mitochondria waarschijnlijk in het controleren van celdood. Hoe doet de mitochondrion dit? Als mitochondrion faalt bij het teweegbrengen van celdood, is kanker vaak het gevolg. Zo, om celdood te regelen, integreren mitochondria signalen van een verscheidenheid van bronnen, die als intrinsieke wegen van apoptosis worden bekend. De componenten van NF-kB activiteit schijnen om één van deze signalen te zijn, hoewel TNFa, een activator van NF-kB, deel van een extrinsieke weg van apoptosis is., Extrinsieke wegen (dood receptor Bemiddeld) worden geïnitieerd buiten de cel, terwijl de intrinsieke wegen van apoptosis worden bemiddeld en in mitochondria teweeggebracht.
In een recente studie van Pazarentzos et al. (2014), werd ikba gevonden om pro-apoptotische activiteit uit te oefenen aangezien het anti-apoptotische NF-kB remde. In de meeste cellen, leidt de activering van NF-kB tot stroomafwaartse uitdrukking van het doelgen die de weerstand van de celdood teweegbrengt (Luo et al., 2005). In deze studie, werd aangetoond dat een nieuwe apoptosisfunctie aan IkBa toe te schrijven was, de subeenheid die de activering van NF-kB remt. Pazarentzos et al., (2014) gevonden dat IkBa lokaliseert aan de OMM waar het interageert met een spanning afhankelijk anion kanaal (VDAC) en mitochondrial hexokinase II (HKII) om dit complex te stabiliseren en BAX-gemedieerde cytochroom C release voor apoptose te voorkomen. Bax is een lid van de Bcl-2-familie van eiwitten, waarvan is aangetoond dat ze regulatoren zijn voor geprogrammeerde celdood (Karbowski et al., 2006).
andere studies hebben ook gewezen op de rol van NF-kB in het directer reguleren van apoptose in de mitochondrion. In een studie van Liu et al., (2004), inhibitie van NF-kB alleen in macrofagen resulteerde in de release van cytochroom c. herinneren dat cytochroom c verantwoordelijk is voor het shuttling elektronen van Complex III aan Complex IV en dat de release van cytochroom C in het cytoplasma, een activator van caspasen, is een belangrijke stap in het teweegbrengen van apoptose.
NF-kB en mitochondriale ademhaling
nucleaire factor kappa B is in vele studies aangetoond dat het de tumorigenese bevordert. Hoe dit gebeurt was niet precies duidelijk. In een baanbrekende studie van Mauro et al., (2011), werd NF-kB gevonden om mitochondrial ademhaling in cellen van het coloncarcinoom upregulate. Hier stelden zij vast dat deze functie van NF-kB het Warburg-effect onderdrukt. Bedenk dat de Warburg effect (Vander Heiden et al., 2009) beschrijft de observatie dat kankercellen neigen om metabolisme door glycolyse eerder dan door de efficiëntere oxydatieve phosphorylation weg te bevoordelen. In deze studie stelden de auteurs vast dat NF-kB netwerken van energiemetabolisme organiseert door de balans tussen glycolyse-gebruik en mitochondriale ademhaling te regelen., Interessant, vonden zij een rol voor NF-kB in metabolische aanpassing in normale cellen en in kanker. Hun resultaten suggereren verder dat het onderdrukken van het mitochondriale metabolisme in gevestigde kankercellen door remming van NF-kB en metformine de tumorigenese vermindert.
NF-kB en mitochondriale genexpressie
nucleaire factor kappa B is een bekende regulator van genexpressie-zowel negatief als positief (Mattson et al., 2000). Nochtans, hoe NF-kB nucleair-gecodeerde mitochondrial genuitdrukking reguleert of beà nvloedt wordt minder begrepen., Menselijke mtDNA bezit 37 genen die voor 13 polypeptiden coderen. Men heeft aangetoond dat de genen van mtDNA voor veel van de subeenheden van alle 5 complexen van de keten van het elektronentransport (enz.), 2 rRNAs, en 22 tRNAs coderen. Hoewel, de meeste ETC subeenheden worden gecodeerd door nucleair DNA, dat kan worden beïnvloed door NF-kB activiteit (Calvo et al., 2016).
bijvoorbeeld, het is geclaimd (Cogswell et al., 2003) dat de NF-kB-weg mitochondriale genuitdrukking die met de subeenheid COX III wordt geassocieerd negatief kan regelen., De COX III subeenheid wordt gecodeerd door mtDNA en is een component van complexe IV in de mitochondriale enz. Het functioneert als een katalytische subeenheid In Complex IV, die het complex geassocieerd met mitochondrial zuurstofverbruik is. In een studie van Cogswell et al. (2003), modulatie van NF-kB activering resulteerde in het verlies van expressie van zowel COX III als cytochroom B mRNA. Andere studies ondersteunen een rol voor NF-kB die extra mitochondriale genen, zoals COX I, en Cytb reguleert (Psarra and Sekeris, 2008, 2009; Barshad et al., 2018b)., Bovendien, verminderde de subeenheid van NF-kB p65 niveaus van mtDNA-gecodeerd CytB mRNA, mogelijk door aan de D-lijn in menselijke cellen in afwezigheid van p53 te binden (Johnson et al., 2011). Globaal, suggereren deze resultaten dat NF-kB het signaleren de enzymatische activiteit van ademhalingscomplexen enz.kan beà nvloeden.
NF-kB bemiddelt Aß-geïnduceerde disfunctie in de mitochondriën
de ziekte van Alzheimer (AD) wordt geassocieerd met de opbouw van Aß-plaques en / of het optreden van neurofibrillaire klitten (NFTs) in bepaalde hersengebieden (Duyckaerts et al., 2009)., Nochtans, bestaat de controverse rond of Aß een veroorzaker van AD is of als Aß eenvoudig met het verouderen wordt gecorreleerd. Accumulerend bewijs (Aliev et al., 2009; Correia et al., 2012; Cadonic et al., 2016; Cardoso et al., 2017; Djordjevic et al., 2017) wijst ook nu op veranderingen in hersenenmetabolisme die door mitochondrial dysfunctie worden gedreven als proces centraal aan vele van de leeftijd afhankelijke neurodegenerative wanorde met inbegrip van advertentie. Toe te voegen aan dit bewijs, zijn er ook stoornissen in enzymatische activiteit van de eiwitcomplexen van de ETC en veranderingen in antioxidant enzymatische activiteit (Kolosova et al.,, 2017) in AD. In het bijzonder is aangetoond dat complexe IV-activiteit negatief wordt beïnvloed in AD (Mutisya et al., 1994).
In een recente studie door Shi et al. (2014), bleek dat Aß verminderde mitochondriale functie via NF-kB signalering. Bovendien, Shi et al. (2014) toonde hier aan dat Aß de uitdrukking van de COX III subeenheid via een NF-kB weg verminderde., Belangrijk, om de mogelijkheid te elimineren dat IkBa werd gefosforyleerd door Aß in het cytoplasma (en vervolgens getransporteerd naar de mitochondriën), geïsoleerde mitochondriën werden geïncubeerd met Aß in de aanwezigheid (of afwezigheid) van een NF-kB blocker, namelijk BAY11-7082. Hier vonden ze Aß veroorzaakte fosforylatie en degradatie van IkBa in geïsoleerde mitochondriën.
Deze bevindingen hebben ook belangrijke implicaties voor de behandeling met AD, zoals blijkt uit recente studies van Snow et al. (2018) en zoals aangetoond in andere gerelateerde studies (Djordjevic et al., 2017; Adlimoghaddam et al.,, 2019) die suggereren het richten van NF-kB signaleren in de mitochondria kan therapeutische waarde hebben. Bijvoorbeeld, in Snow et al.de studie, creatine-a known modulator of mitochondrial function (Tarnopolsky and Beal, 2001), toonde aan om eiwitniveaus van CaMKII, PSD-95, en complexe 1 subeenheden in creatine gevoede muizen te verhogen en positief te veranderen, terwijl de NF-kB remmende IKB subeenheid werd verlaagd. Voor meer informatie over het potentiële therapeutische effect van creatine op de mitochondriale functie en bij mitochondriale aandoeningen of andere neurologische aandoeningen, zie studies en reviews door Matthews et al., (1998), Klivenyi et al. (1999), Tarnopolsky and Beal (2001), Hersch et al. (2006), Rodriguez et al. (2007) en Beal (2011).
NF-kB ’s rol in inflammatie en mitochondriaal metabolisme
toenemende gegevens (Lama’ s et al., 2003; Mauro et al., 2011; Moretti et al., 2012) suggereren dat NF-kB signalering, die een mediator van ontstekingsprocessen is, ook functioneert als een regulator en integrator met energiemetabolisme. In een recente studie van Zhong et al. (2016), werd NF-kB getoond om inflammasome activering via verwijdering van beschadigde mitochondria te beperken., Verrassend genoeg bleek NF-kB zowel het nlrp-3 inflammasoom voor activering te primen als overmatige ontstekingen te voorkomen en de nlrp-3 inflammasoom activering tegen te houden; hoewel het mechanisme voor terughoudendheid slecht gedefinieerd was. Hier werd gespeculeerd dat naast NF-kB die een activator van ontstekingsgenen is, het ook in deze studie functioneerde door nlrp3 inflammasome activering en IL-1β productie te beperken. Bovendien werd gevonden dat P62 inductie verantwoordelijk was voor de inflammasome remmende activiteit door NF-kB., Het lijkt erop dat NF-kB zijn eigen ontsteking in macrofagen kan beperken door P62 gemedieerde verwijdering van beschadigde mitochondriën (mitofagie) te bevorderen nadat macrofagen met verschillende nlrp3 inflammasome activatoren interageren.
conclusie
meer dan 10 jaar geleden werd NF-kB gedetecteerd in de mitochondriën. Verrassend, voor zo ‘ n belangrijke transcriptiefactor, is weinig vooruitgang geboekt in het blootleggen van specifieke rollen voor NF-kB die de mitochondrion beïnvloeden., Sommige studies, zoals hierboven beschreven, leveren bewijs voor NF-kB in mitochondriale dynamica, apoptose, respiratoire controle, genexpressie, en mechanismen van de ziekte (figuur 1). Andere laboratoria moeten echter nog steeds dupliceren van deze resultaten en algemene validatie. Sommige extra inzicht kan worden afgeleid uit het feit dat andere transcriptiefactoren die effecten hebben op nucleaire genen, zoals AP-1, p53, CREB, c-Myc, Wnt13, Dok-4, HMGA1, en C-Src ook zijn ontdekt in de mitochondriën (Psarra en Sekeris, 2008)., Interessant, zijn de verbindingsplaatsen in het mitochondrial genoom (homologe aan hun verbindingsplaatsen in het nucleaire DNA) voor sommige van deze factoren bepaald (Psarra en Sekeris, 2008) waar de rollen voor mitochondrial transcriptie en apoptosis worden vermoed en sommige algemene patronen van activiteit tonen. Bijvoorbeeld, kan een argument worden gemaakt dat sommige van deze factoren (NF-kB, CREB, en AP-1) binden aan mitochondriale genomen en meestal mitochondriale genexpressie verzwakken (Blumberg et al., 2014), terwijl het hebben van stimulerende effecten op nucleaire gen transcriptie., Er is echter duidelijk meer werk nodig om niet alleen de precieze rollen van de activiteit te vinden, maar ook om te bepalen of er werkelijk algemene patronen van activiteit bestaan.
na onderzoek van deze literatuur wordt ook duidelijk dat de rol van NF-kB in de regulatie van mitochondriale ademhaling diepgaande implicaties heeft en een niveau van complexiteit vertoont dat niet eerder werd gewaardeerd. Bijvoorbeeld, Mauro et al. (2011) de gegevens stellen een rol voor NF-kB in metabolische aanpassing in normale cellen en in kanker vast, en suggereren ook gevolgen voor andere ziektestaten zoals advertentie., Bovendien, gezien het feit dat NF-kB zijn eigen ontsteking kan beperken, zoals aangetoond door Zhong et al. (2016), niet alleen is verrassend, maar verder illustreert de complexiteit van NF-kB signalering in mitochondriale functie.
in dit overzicht werden studies onderzocht naar de rol van NF-kB in de mitochondriale functie, en het lijkt erop dat het onderzoek op dit gebied toeneemt. Het compliceren van de resultaten is echter de observatie dat de veelvoudige factoren gelijkaardige rollen in mitochondrial functie Spelen en zo gedetailleerde studies specifiek voor elke factor noodzakelijk zijn., Tot slot kunnen we de vraag opnieuw stellen-Wat doet NF – kB in en aan de mitochondrion? De onmiddellijke en verkorte antwoord zou zijn-veel!
Auteursbijdragen
de auteur creëerde het onderwerp en schreef het manuscript.deze werkzaamheden werden gefinancierd door de Canadian Institutes of Health Research (CIHR), Canadian Agricultural Partnership (CAP), St.Boniface Hospital Research Foundation, Alzheimer Society of Manitoba, Research Manitoba, The Honourable Douglas and Patricia Everett, en Royal Canadian Properties Limited Endowment Fund.,
belangenconflict verklaring
de auteur verklaart dat het onderzoek werd uitgevoerd zonder commerciële of financiële relaties die als een potentieel belangenconflict kunnen worden opgevat.
Dankbetuigingen
de auteur wil Dr.Grant Hatch bedanken voor een recensie van het manuscript.
Hayden, M. S., and Ghosh, S. (2004). Signaal naar NF-kappaB. Genes Dev. 18, 2195–2224.
PubMed Abstract/Google Scholar
Wang, X. En Chen, X. J. (2015)., Een cytosolisch netwerk dat mitochondria-gemedieerde proteostatische stress en celdood onderdrukt. Nature 524, 481-484. doi: 10.1038 / nature14859
PubMed Abstract / CrossRef Full Text / Google Scholar