kanker verwijst naar een complexe en heterogene groep ziekten die wordt gekenmerkt door een ongecontroleerde en wanordelijke proliferatie van cellen, die vaak het vermogen verwerven om andere weefsels binnen te dringen. Kanker ontstaat gewoonlijk in somatische cellen die, als gevolg van een reeks genetische mutaties, de mechanismen ontwijken die weefselhomeostase reguleren, zoals cel-tot-cel contactremming, differentiatiesignalen en celdoodinductie., De mutaties die verantwoordelijk zijn voor tumortransformatie betreffen twee hoofdgroepen van genen, bekend als proto-oncogenen (stimulatoren van de celcyclus) en tumoronderdrukkers (onderdrukkers van de progressie van de celcyclus). Deze functionele veranderingen kunnen als gevolg van enige nucleotideveranderingen voorkomen, maar zij kunnen ook door grotere wijzigingen in genetisch materiaal, zoals inserties, schrappingen, duplicaties of translocaties van een chromosomisch fragment worden veroorzaakt. Deze afwijkingen in kankercellen kunnen als tumorbiomerkers worden gebruikt., De kwantificering van veranderingen in het aantal van het genexemplaar of genherschikkingen is kritiek aan ons begrip van tumorbiologie, vandaar het belang van genetische tests die op moleculaire cytogeneticaprofilering worden gebaseerd.
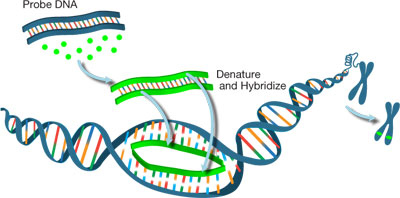
figuur 1: Labeling DNA probe for fish analysis.
Wat is FISH ?
fluorescentie in situ hybridisatie (Fish) is een cytogenetische techniek die wordt gebruikt voor de detectie en lokalisatie van nucleotidesequenties (DNA of RNA) binnen weefsels of cellen., Vissen kunnen worden gebruikt voor het “in kaart brengen” van het genetische materiaal in menselijke cellen, het verstrekken van informatie over de plaats, de lengte en het aantal kopieën van specifieke genen of chromosoomdelen. Het vereist de synthese van een fluorescently-geëtiketteerde sonde, die een nucleic zure opeenvolging is die aan een fluorescente verslaggeversmolecule wordt gebonden, die dan aan een specifieke doelopeenvolging zal binden (kruisen). Vis sondes kunnen worden geëtiketteerd door verschillende methoden (b. v. nick vertaling, random priming), uitgaande van verschillende nucleïnezuren inputs, zoals genomic DNA/RNA, bacteriële kunstmatige chromosomen (BACs), of kosmiden., de eerste stap in het FISH-proces is het immobiliseren van metafasechromosomale spreads of interfasecellen die het doeldna op een glasplaatje bevatten. Vervolgens worden zowel het DNA-specimen als de vissonde gedenatureerd door hitte. Wanneer de sonde in contact is met het doel genetisch materiaal, zal het specifiek aan zijn complementaire opeenvolging op het chromosoom binden. De hybriden die tussen de sondes en hun opeenvolgingsdoelstellingen worden gevormd kunnen dan worden gevisualiseerd gebruikend een fluorescente microscoop (figuur 1)., In het algemeen, kunnen twee types van vissen sondes worden onderscheiden: de chromosoomtelling sondes (CEPs of CENs) die de pericentromere gebieden van chromosoom richten en worden gebruikt om chromosomen te tellen; en locus-specifieke indicatoren (LSI) die specifiek genen van belang erkennen.
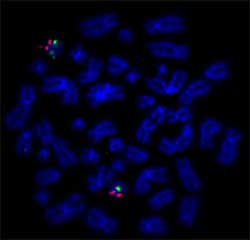
Figuur 2: voorbeeld van FISH resultaten: Nick Translation DNA Labeling System 2.0 werd gebruikt voor het labelen van BAC DNA probe voor TP53 met SEEBRIGHT® Orange 552 dUTP en BAC DNA probe voor Centromere 17 met SEEBRIGHT® Green 496 dUTP., Gelabelde sondes werden gekruist met metafase-spreads. (Institut Universitaire du Cancer Toulouse Oncopole)
Vis heeft verschillende voordelen ten opzichte van andere klassieke cytogenetische technieken, zoals het Karyotyperen van G-banding. Ten eerste heeft het een hogere resolutie (20-150kb vs 5Mb). Bovendien kunnen de vissen op zowel metafase als interfasechromosomen worden toegepast, betekenend dat de cellen niet verscheidene dagen moeten worden gekweekt alvorens de chromosomen voor analyse kunnen worden voorbereid., Dit impliceert ook dat de vissen geschikt zijn voor de analyse van verschillende soorten steekproeftypes met inbegrip van stevige tumors en formaline-vaste paraffine-ingebedde (FFPE) weefsels. Voorts kunnen de sondes van de vissen met verschillende fluorophores worden geëtiketteerd, die voor het gelijktijdige toezicht van veelvoudige plaatsen toestaan. Fish-ing chromosoomafwijkingen bij kankerdankzij zijn veelzijdigheid kan FISH worden gebruikt voor de cytogenetische analyse van zowel vaste tumoren (bv. borstkanker, niet-kleincellige longkanker, colorectale kanker) als hematologische of bloedkanker (bv. leukemie, lymfomen, multipel myeloom)., De opsporing van genetische abnormaliteiten is niet alleen nuttig voor kanker, maar ook als hulpmiddel om genetische predispositie en ziekte-specifieke informatie te analyseren, en om een chemotherapeutische uitkomst te voorspellen.
FISH voor longkanker
longkanker is de meest gediagnosticeerde en belangrijkste oorzaak van kankergerelateerde sterfgevallen. Met name de niet-kleincellige longkanker (NSCLC) is verantwoordelijk voor ~80-85% van alle longkanker. Somatische mutaties op EGFR-en ALK-genen worden vaak geassocieerd met NSCLC., EGFR (epidermale groeifactor Receptor) is een klasse van tyrosinekinasereceptoren waarvan de activiteit wordt gedereguleerd in verschillende soorten epitheliale maligniteiten (waaronder longkanker), omdat ze een belangrijke rol spelen bij de proliferatie van kankercellen, angiogenese en metastase. Om deze reden worden verschillende strategieën om de EGFR-functie te verstoren vaak gebruikt voor de therapie van patiënten. Remmers van de tyrosinekinaseactiviteit van deze receptoren (bijv. erlotinib, gefitinib) worden veel gebruikt bij klinische NSCLC-behandelingen., Helaas, vanwege de verscheidenheid aan genetische mutaties die ten grondslag liggen aan de EGFR disfunctie, zijn sommige patiënten ongevoelig voor dit type behandeling. Verschillende groepen patiënten kunnen inderdaad worden onderscheiden op basis van het type verandering dat door EGFR wordt gedragen, zoals genamplificatie, deletie of enkelvoudige nucleotide substituties, die de activiteit op verschillende manieren kunnen veranderen (d.w.z. niet via het tyrosinekinasedomein). Als gevolg hiervan is het EGFR-kopieergetal bepaald door FISH een van de biomarkers die gebruikt worden om de juiste therapie te selecteren.,
FISH wordt vaak gebruikt om inversies of translocaties in het ALK-gen te detecteren. Het ALK-gen wordt gevestigd op de korte arm van chromosoom 2 (2p23) en codeert voor de transmembraantyrosinekinasereceptor. ALK mag niet tot expressie komen in de volwassen long. Onder pathologische omstandigheden breekt het ALK-gen echter en fuseert het 3′ (dat het tyrosinekinasedomein bevat) met 5′ van andere genen. Deze gebeurtenis kan tot de ongecontroleerde activering van ALK stroomafwaarts signalerende wegen leiden. De meest voorkomende fusie komt voor met EML4, vanwege een inversie op de korte arm van chromosoom 2.,
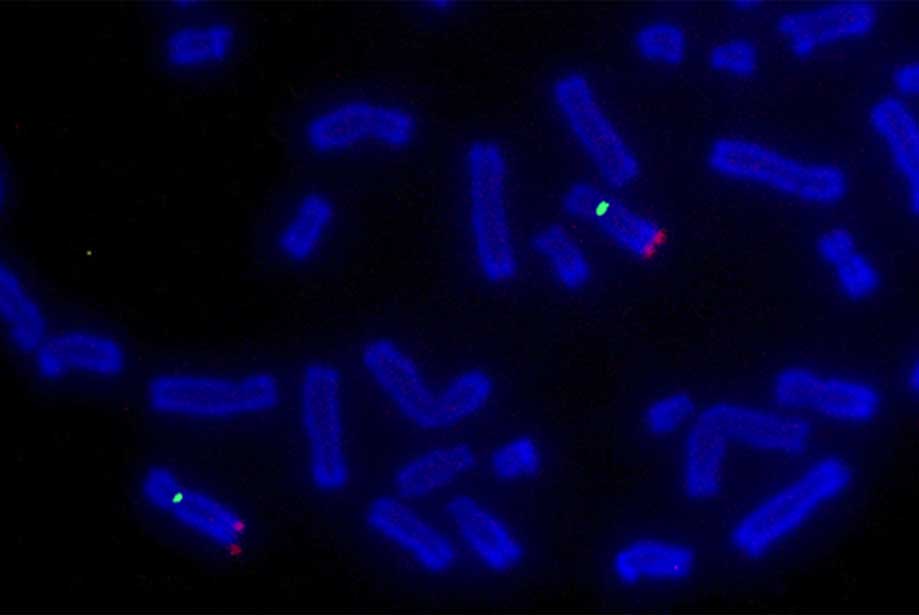
FISH is de door de FDA goedgekeurde methode om inversies of translocaties in ALK-gen te detecteren. Typisch, worden de sondes die het 3′ en het 5′ gebied van het gen richten geëtiketteerd met verschillende fluorophores: in negatieve kernen, zullen de kleuren dicht aan elkaar verschijnen (vaak overlappend), terwijl in kankercellen de signalen als resultaat van de chromosoomherschikking (Figuur 4) zullen splitsen.

Figuur 3: Representative view of ALK gen translocation detected by FISH., 5′ en 3 ‘ gebieden van het gen worden gevisualiseerd met een groene en een rode fluorescentie respectievelijk. A. kern van het wildtype. B. Kankercelkern, waaruit blijkt dat de karakteristieke sondes splitsen. C. kanker celkern, die de karakteristieke sondes splitsen. Een derde sonde kan worden gebruikt om de chromosoomherschikking te definiëren die eigenlijk voorkomt.
Een derde probe gericht op de potentiële ALK-partner kan de chromosoomherschikking die bij een patiënt optreedt, verder bevestigen en definiëren (figuur 4C)., Longkanker met mutaties die leiden tot ALK-hyperactivatie kan worden behandeld met ALK-remmers zoals Crizotinib.
vissen op borstkanker
Dit is de meest voorkomende maligniteit bij vrouwen en de op één na belangrijkste oorzaak van kankergerelateerde sterfte wereldwijd. Borstkanker wordt vaak gekenmerkt door afwijkingen in receptorstatus, wat leidt tot een upregulation van cellulaire transductiewegen verantwoordelijk voor celproliferatie en overleving. In het bijzonder, ongeveer 20-30% van borstkanker tumoren zijn bekend om overexpressie HER2/Neu, een lid van de EGFR-familie., Een gemeenschappelijke behandeling in deze gevallen is Trastuzumab, een gehumaniseerd monoclonal antilichaam dat door FDA in 1998 voor de behandeling van borstkanker wordt goedgekeurd. Zijn nauwkeurige moleculaire mechanisme moet nog worden opgehelderd, maar dit antilichaam verhindert waarschijnlijk HER2 activering door aan zijn extracellulair domein te binden. Bovendien lijkt het tumorcellysis te induceren die de antilichaam-afhankelijke cellulaire cytotoxiciteit (ADCC) stimuleert. FISH kan, met behulp van een geschikte sonde tegen HER2, worden gebruikt om extra kopieën van het gen te identificeren, een teken dat het waarschijnlijker reageert op behandeling met Trastuzumab.,
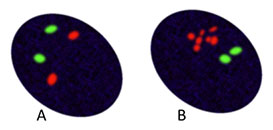
Figuur 4: representatieve weergave van mogelijke borstcarcinoomcellen. Het signaal van HER2 wordt vertegenwoordigd in rood; centromere 17 sonde (groen) kan worden gebruikt om chromosoomaantal op te sommen. A. HER2-niet-versterkt borstcarcinoom: twee centromeren 17 en twee kopie van het HER2 gen zoals verwacht. B. HER2-versterkt borstcarcinoom meervoudige detectie voor HER2.
vis voor blaaskanker
het is de vijfde meest voorkomende humane maligniteit en de tweede meest gediagnosticeerde urogenitale tumor na prostaatkanker., Het is een polygene ziekte, wat betekent dat het is geassocieerd met meerdere genetische afwijkingen, zoals mutaties in FGFR3, RB1, HRAS, TP53 of tsc1 genen. Het initiatiegebeurtenis is echter waarschijnlijk een mutatie in het 9p21-gebied, dat het P16/CDKN2A-gen bevat. Bovendien worden blaaskankercellen gekenmerkt door een verhoogde mate van chromosoominstabiliteit (CIN). Disfunctionele chromosoomduplicatie of segregatie tijdens mitose veroorzaakt DNA herschikkingen en translocaties, winst of verlies van hele chromosomen (aneuploïdie) of chromosoomfragmenten., De resulterende onbalans van het genetische materiaal verergert na elke celcyclus. De consequente genomic patronen kunnen worden gerelateerd aan de verschillende stadia van tumorontwikkeling, met de meer invasieve vormen die het hogere aantal cytogenetische wijzigingen tonen.
De numerieke en structurele chromosomale veranderingen gevonden in blaaskanker cellen kunnen worden gebruikt als tumormarkers.
het gelijktijdig detecteren van de variatie van het aantal kopieën van chromosomen 3, 7 en 17 en het verwijderen van het 9p21-gebied (dat p16 bevat) door FISH met behulp van vier verschillende sondes is een gangbare praktijk., Deze methode is nuttig voor het verstrekken van informatie over kankervooruitgang en herhaling. de analyse van hematologische maligniteiten is een van de typische voorbeelden van de voordelen van FISH voor de analyse van monsters die gekenmerkt worden door een variabel karyotype en een lage mitotische activiteit. CLL is de meest voorkomende leukemie bij volwassenen. Het is niet geassocieerd met een specifieke terugkerende genetische verandering., In plaats daarvan, vergelijkbaar met blaaskanker, is een panel van verschillende mutaties geassocieerd met verschillende ernst van de ziekte en wordt gebruikt als voorspellende indicatoren van de patiënt klinische cursus. VISPANELEN bevatten in dit geval vaak sondes om trisomie 12 en deleties 11q, 13q en 17p te detecteren., Deletie 11q, die in de meeste gevallen betreft het ATM-gen is gevonden in patiënten met snelle progressie van de kanker; trisomie 12 wordt geassocieerd met gevorderde stadia van de ziekte, resistentie voor chemotherapie en een kortere overlevingsduur; verwijderen 13q is de meest voorkomende en wordt in het algemeen geassocieerd met een meer gunstige prognose; verwijderen 17p bevat vaak een verwijdering van TP53 gen en komt overeen met een gevorderd stadium van de tumor, met een slechte overleving.Enzo Life Sciences is een wereldleider op het gebied van DNA-en RNA-etiketteringstechnologieën., Wij bieden een scala aan producten voor uw Genomica en kankeronderzoek behoeften. Voor een eenvoudige en efficiënte methode voor het genereren van gelabeld DNA, kijk dan op onze Nick translation DNA labeling kit evenals een lijst van onze SEEBRIGHT® fluorescerende dye-dUTPs en onze Allylamine-dUTP. Weet u niet zeker of u biotine of digoxigenine moet gebruiken voor ISH-sondeetikettering? Wij kunnen u daarbij helpen! Vergeet niet om Enzo ‘ s spectra kijker voor opwinding en emissie golflengteprofielen van gemeenschappelijke kleurstoffen en onze andere op fluorescentiecel-gebaseerde analyses te controleren., Als je toch bezig bent, bekijk dan onze TechNote over de voor-en nadelen van vis, aCGH en NGS en hoe je allylamine-dUTP gebruikt voor het labelen van VISDNA-sonde. Voor alle vragen en zorgen met betrekking tot een van onze producten, Onze technische Support Team is hier om te helpen.