leerdoelstellingen
- definiëren corrosie
- een lijst maken van enkele methoden die worden gebruikt om corrosie te voorkomen of te vertragen
corrosie wordt meestal gedefinieerd als de afbraak van metalen als gevolg van een elektrochemisch proces. De vorming van roest op ijzer, aantasting op zilver, en de blauw-groene patina die zich ontwikkelt op koper zijn allemaal voorbeelden van corrosie., De totale kosten van corrosie in de Verenigde Staten zijn aanzienlijk, met schattingen van meer dan een half biljoen dollar per jaar.
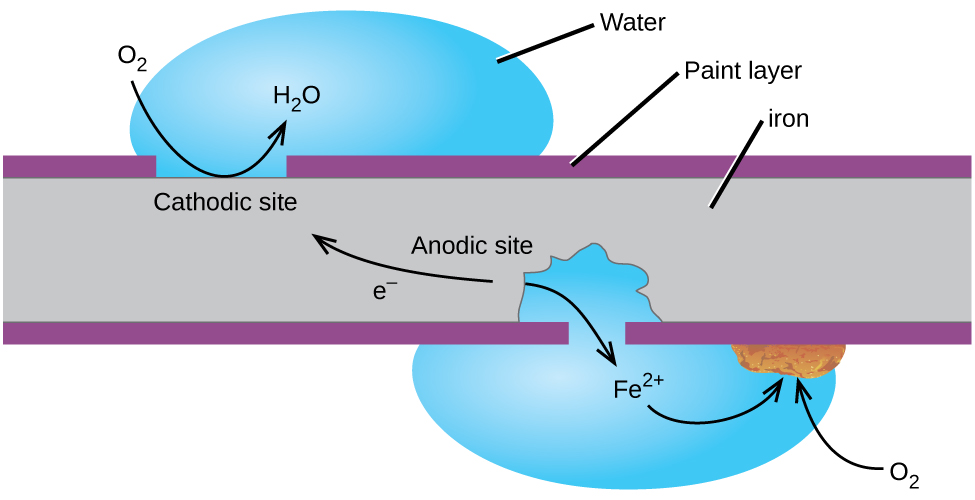
misschien wel het meest bekende voorbeeld van corrosie is de vorming van roest op ijzer. Ijzer zal roesten wanneer het wordt blootgesteld aan zuurstof en water. De belangrijkste stappen in het roesten van ijzer lijken het volgende te omvatten (Figuur 2). Eenmaal blootgesteld aan de atmosfeer, oxideert ijzer snel.
de elektronen verminderen zuurstof in de lucht in zure oplossingen.
Wat wij noemen roest is gehydrateerd ijzer(III) oxide, welke vormen wanneer ijzer(II) ionen reageren verder met zuurstof.,
Het aantal watermoleculen is variabel, dus het wordt vertegenwoordigd door x. In tegenstelling tot de patina op koper, roest-niet het maken van een beschermende laag en dus corrosie van het ijzer blijft de roest vlokken uit en onthult vers ijzer aan de sfeer.
een manier om te voorkomen dat ijzer corrodeert, is door het geschilderd te houden. De verflaag voorkomt dat het water en de zuurstof die nodig zijn voor roestvorming in contact komen met het ijzer. Zolang de verf intact blijft, wordt het ijzer beschermd tegen corrosie.,
andere strategieën omvatten het legeren van het ijzer met andere metalen. Bijvoorbeeld, roestvrij staal is meestal ijzer met een beetje chroom. Het chroom heeft de neiging om te verzamelen in de buurt van het oppervlak, waar het vormt een oxide laag die het ijzer beschermt.
verzinkt of gegalvaniseerd ijzer gebruikt een andere strategie. Zink wordt gemakkelijker geoxideerd dan ijzer omdat zink een lager reductiepotentieel heeft. Aangezien zink een lager reductiepotentieel heeft, is het een actiever metaal. Dus, zelfs als de zinklaag is bekrast, zal het zink nog steeds oxideren voordat het ijzer., Dit suggereert dat deze aanpak moet werken met andere actieve metalen.
een andere belangrijke manier om metaal te beschermen is om het de kathode in een galvanische cel te maken. Dit is kathodische bescherming en kan worden gebruikt voor andere metalen dan alleen ijzer. Zo kan het roesten van ondergrondse ijzeren opslagtanks en leidingen worden voorkomen of sterk worden verminderd door deze aan te sluiten op een meer actief metaal zoals zink of magnesium (Figuur 3). Dit wordt ook gebruikt om de metalen onderdelen in boilers te beschermen., De meer actieve metalen (lagere reductiepotentiaal) worden sacrificial anodes genoemd omdat ze uitgeput raken als ze corroderen (oxideren) aan de anode. Het metaal dat wordt beschermd dient als kathode en oxideert dus niet (corrodeert). Wanneer de anodes goed worden gecontroleerd en periodiek worden vervangen, kan de nuttige levensduur van de ijzeren opslagtank aanzienlijk worden verlengd.
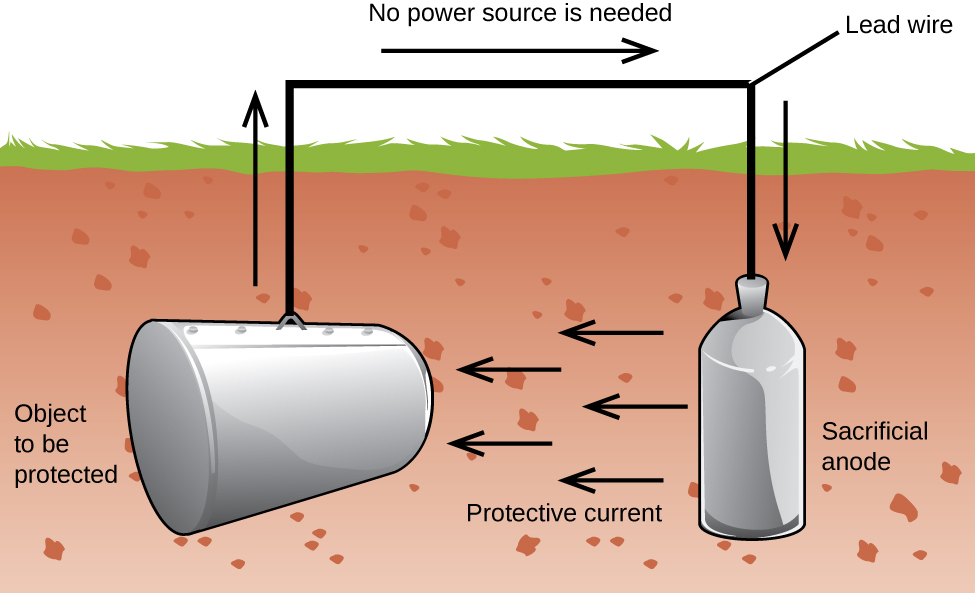
corrosie is de afbraak van een metaal veroorzaakt door een elektrochemisch proces. Elk jaar worden grote sommen geld uitgegeven om de effecten van corrosie te herstellen of te voorkomen. Sommige metalen, zoals aluminium en koper, produceren een beschermende laag wanneer ze corroderen in de lucht., De dunne laag die zich vormt op het oppervlak van het metaal voorkomt dat zuurstof in contact komt met meer van de metaalatomen en zo “beschermt” het resterende metaal tegen verdere corrosie. Ijzer corrodeert (vormt roest) bij blootstelling aan water en zuurstof. De roest die zich vormt op ijzermetaal vlokken af, het blootstellen van vers metaal, die ook corrodeert. Een manier om corrosie te voorkomen of te vertragen is door het metaal te coaten. Coating voorkomt dat water en zuurstof in contact komen met het metaal. Verf of andere coatings zal vertragen corrosie, maar ze zijn niet effectief eenmaal bekrast., Verzinkt of gegalvaniseerd ijzer exploiteert het feit dat zink meer kans om te oxideren dan ijzer. Zolang de coating blijft, zelfs als het bekrast is, zal het zink oxideren voordat het ijzer. Een andere methode voor de bescherming van metalen is kathodische bescherming. Bij deze methode wordt een gemakkelijk geoxideerd en goedkoop metaal, vaak zink of magnesium (de offeranode), elektrisch verbonden met het metaal dat moet worden beschermd. Het meer actieve metaal is de offeranode, en is de anode in een galvanische cel. Het “beschermde” metaal is de kathode, en blijft ongeoxideerd., Een voordeel van kathodische bescherming is dat de offeranode gemonitord en indien nodig vervangen kan worden.,
verklarende woordenlijst
kathodische beschermingsmethode om metaal te beschermen met behulp van een offeranode en het metaal dat de kathode moet beschermen effectief te maken, waardoor de oxidatie corrosie afbraak van metaal door een elektrochemisch proces wordt voorkomen gegalvaniseerde ijzermethode om ijzer te beschermen door het te bedekken met zink, dat vóór het ijzer oxideert; verzinkte offeranode van ijzer actiever, goedkoop metaal gebruikt als de anode in kathodische bescherming; vaak gemaakt van magnesium of zink
oplossingen
antwoorden op scheikunde einde van hoofdstuk Oefeningen
2., Mg en Zn
4. Beide voorbeelden betreffen kathodische bescherming. De (offer) anode is het metaal dat corrodeert (oxideert of reageert). In het geval van ijzer (-0,447 V) en zink (-0,7618 V) heeft zink een meer negatief standaard reductiepotentieel en dient het dus als anode. In het geval van ijzer en koper (0,34 V), ijzer heeft de kleinere standaard reductiepotentieel en dus corrodeert (dient als de anode).
6., Hoewel het reductiepotentieel van lithium het in staat zou stellen de andere metalen te beschermen, is dit hoge potentieel ook indicatief voor hoe reactief lithium is; het zou een spontane reactie hebben met de meeste stoffen. Dit betekent dat het lithium snel zou reageren met andere stoffen, zelfs die die het metaal dat het probeert te beschermen niet zouden oxideren. Reactiviteit zoals deze betekent dat de offeranode snel uitgeput zou zijn en vaak vervangen moet worden. (Facultatieve bijkomende reden: brandgevaar in aanwezigheid van water.)