De Brønsted-Lowry Theorie over Zuren en Basen
Brønsted-Lowry theorie van zuur en basen nam de Arrhenius definitie een stap verder, als een stof niet meer nodig is samengesteld uit waterstof (H+) en hydroxide (OH-) ionen om te worden geclassificeerd als een zuur of base. Neem voor exmapl de volgende chemische vergelijking:
\
- Een Brønsted-Lowry-zuur is een proton (waterstofion) donor.
- een Brønsted-Lowry-base is een proton (waterstofion) acceptor.,
in deze theorie is een zuur een stof die een proton kan afgeven (zoals in de Arrhenius-theorie) en een base is een stof die een proton kan accepteren., Een basic salt, zoals Na+F-, genereert OH – – ionen in water door het nemen van protonen van het water zelf (naar HF):
\
- Zuur dissociatie
\
- Zuur Ionisatie Constante:
\}{}\]
- Base dissociatie:
\
- Base Ionisatie Constante
\}{}\]
De bepaling van een stof als een Brønsted-Lowery zuur of base kan alleen gedaan worden door het observeren van de reactie. In het geval van de HOH is het een base in het eerste geval en een zuur in het tweede geval.,
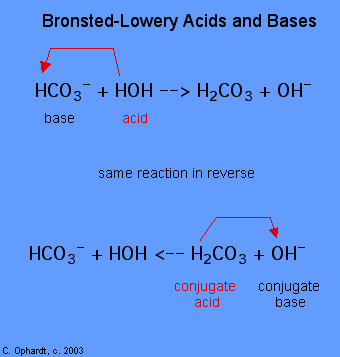
om te bepalen of een stof een zuur of een base is, tel de waterstofstoffen op elke stof voor en na de reactie. Als het aantal waterstofstoffen is gedaald, is die stof het zuur (doneert waterstofionen). Als het aantal waterstofstoffen is toegenomen, is die stof de base (accepteert waterstofionen). Deze definities worden normaal gesproken toegepast op de reactanten aan de linkerkant. Als de reactie omgekeerd wordt bekeken, kunnen een nieuw zuur en base worden geïdentificeerd., De stoffen aan de rechterkant van de vergelijking worden geconjugeerd zuur en geconjugeerde base genoemd in vergelijking met die aan de linkerkant. Merk ook op dat het originele zuur in de geconjugeerde base verandert nadat de reactie voorbij is.
Note
zuren zijn Protondonoren en basen zijn Protonacceptoren
om een reactie in evenwicht te brengen moet een overdracht van elektronen plaatsvinden. Het zuur zal een elektron weggeven en de base zal het elektron ontvangen. Zuren en basen die op deze manier samenwerken worden een geconjugeerd paar genoemd dat uit geconjugeerde zuren en geconjugeerde basissen wordt samengesteld.,
\
A staat voor een zure verbinding en Z staat voor een basische verbinding
- A doneert H om HZ+te vormen.
- Z accepteert H van A die Hz vormt +
- A – wordt geconjugeerde base van HA en in de omgekeerde reactie accepteert het een H van HZ om HA te recreëren om in evenwicht te blijven
- HZ+ wordt een geconjugeerd zuur van Z en in de omgekeerde reactie doneert het een H aan A-recreerend Z om in evenwicht te blijven