Het 1913 Bohr model van het waterstofatoom werd vervangen door Schrodingerss wave mechanical model in 1926. Echter, Bohrss model is nog steeds winstgevend onderwezen vandaag vanwege zijn conceptuele en wiskundige eenvoud, en omdat het introduceerde een aantal belangrijke kwantummechanische ideeën zoals het kwantumgetal, kwantisatie van waarneembare eigenschappen, kwantumsprong en stationaire toestand.,
Bohr berekende de variëteit van toegestane elektronenenergieën door de mechanische krachten (centripetaal en elektronenkern) te balanceren op een elektron die een cirkelbaan van straal R om de kern uitvoert, en vervolgens willekeurig zijn impulsmoment kwantificeren. Ten slotte verklaarde fiat dat het elektron zich in een niet-stralende stationaire toestand bevond omdat een omcirkelende (versnellende) lading energie uitstraalt en zal instorten in de tegengestelde ladingskern.,in 1924 postuleerde de Broglie Golf-deeltjedualiteit voor het elektron en andere massieve deeltjes, waardoor de mogelijkheid werd geboden om een deel van de willekeur uit het bohrss-model te verwijderen. Bijvoorbeeld, is een elektron die golfeigenschappen bezit onderworpen aan constructieve en destructieve interferentie. Zoals zal worden aangetoond leidt dit natuurlijk tot kwantisatie van elektronenmoment en kinetische energie, en bijgevolg een variëteit van toegestane energietoestanden voor het elektron ten opzichte van de kern., Het de Broglie‐Bohr model van het hier gepresenteerde waterstofatoom behandelt het elektron als een deeltje op een ring met golfachtige eigenschappen.
\
de hypothese van de Broglie dat materie golfachtige eigenschappen heeft.
\
het gevolg van de broglieʹs hypothese; een integraal aantal golflengten moet binnen de omtrek van de baan passen. Dit introduceert het kwantumgetal dat waarden 1,2,3, kan hebben… De N = 4 elektron toestand wordt hieronder getoond.,
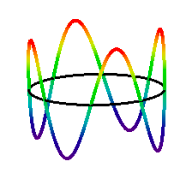
\
substitutie van de eerste vergelijking in de tweede vergelijking laat zien dat momentum wordt gekwantiseerd.
\
als momentum gekwantiseerd is, is kinetische energie dat ook.
\
wat betekent dat de totale energie wordt gekwantiseerd. De tweede term is de elektron-proton elektrostatische potentiële energie.
de kwantummechanische interpretatie van deze ʺBohr orbitsʺ is dat ze stationaire toestanden zijn. Ondanks het feit dat we de uitdrukking kinetische energie gebruiken, die elektronenbeweging impliceert, is er geen beweging., Het elektron neemt de baan in als een deeltjesgolf, het draait niet om de kern. Als het in klassieke zin rond zou draaien zou het energie uitstralen en snel in de kern instorten. Het is duidelijk dat de stabiliteit van materie de kwantummechanische versie van kinetische energie vereist.
De aardenergie en de baanstraal van het elektron in het waterstofatoom wordt gevonden door de energie uit te zetten als functie van de baanstraal. De grondtoestand is het minimum in de totale energiecurve., Natuurlijk kan calculus worden gebruikt om dezelfde informatie te verkrijgen door het minimaliseren van de energie ten opzichte van de baanradius. Echter, de grafische methode heeft de deugd van het verlichten van de kwestie van atomaire stabiliteit.
fundamentele constanten: elektronlading, elektronmassa, Planck ‘ s constante, vacuümpermitiviteit.
kwantumgetal en omzettingsfeit tussen meters en picometers en Joule en attojoule.
\
\
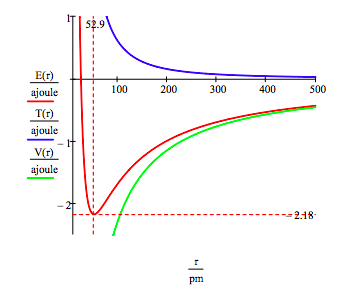
deze figuur toont aan dat atomaire stabiliteit een evenwicht tussen potentiële en kinetische energie impliceert., Het elektron wordt naar de kern getrokken door de aantrekkelijke potentiële energie-interactie (~ -1/R), maar wordt verhinderd in de kern in te storten door de extreem grote kinetische energie (~1/R2) geassocieerd met kleine banen.
zoals hieronder getoond, kan de grafische benadering ook worden gebruikt om de elektronische opgewonden toestanden te vinden.
\
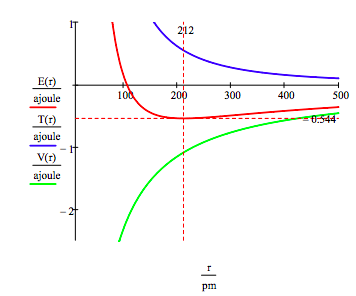
zoals eerder vermeld kan de variëteit van toegestane elektronenenergieën ook worden verkregen door de energie ten opzichte van de baanstraal te minimaliseren. Deze procedure levert
op