Inleiding
elektronen hebben geen vaste positie in atomen, verbindingen en moleculen (zie afbeelding hieronder), maar hebben de kans om in bepaalde ruimten (orbitalen) te worden gevonden. Resonantievormen illustreren gebieden met hogere waarschijnlijkheden (elektrondichtheden). Dit is alsof je je hoed in je rechterhand of in je linkerhand houdt. De term resonantie wordt toegepast wanneer er twee of meer mogelijkheden beschikbaar zijn., Chemici gebruiken Lewis diagrammen om structuur en binding van covalente entiteiten, zoals moleculen en polyatomische ionen, voortaan moleculen weer te geven. Het Lewis diagram van menig molecuul is echter niet consistent met de waargenomen eigenschappen van het molecuul.
voorbeeld \ (\Pagindex{1}\): Nitraation
het nitraation heeft volgens het Lewis-diagram twee soorten stikstof-zuurstofbindingen, één dubbele binding en twee enkelvoudige bindingen, wat suggereert dat één stikstof-zuurstofbinding in het nitraation korter en sterker is dan elk van de andere twee., Ook impliceert de Lewis-structuur, met betrekking tot formele lading, dat er twee soorten zuurstofatomen in het nitraat-ion zijn, één formeel neutraal en elk van de andere twee met een formele lading van -1. Experimenteel, echter, de drie stikstof-zuurstof bindingen in het nitraat ion hebben dezelfde bindingslengte en dezelfde bindingsenergie, en de drie zuurstofatomen zijn niet te onderscheiden. Het Lewis-diagram kan de structuur en binding van het nitraat-ion niet op bevredigende wijze verklaren.
Voor het nitraat-ion kunnen twee extra Lewis-diagrammen worden getekend.,
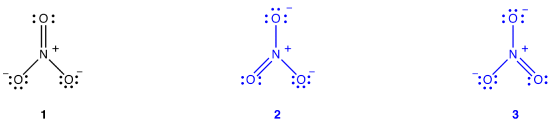
echter, geen van hen is consistent met de waargenomen eigenschappen van het nitraation en geeft daarom het nitraation niet correct weer.
voorbeeld \ (\Pagindex{2}\): benzeen
benzeen heeft volgens het Lewis-diagram twee soorten koolstof-koolstofbindingen, drie dubbele bindingen en drie enkelvoudige bindingen, wat suggereert dat elk van de drie koolstof-koolstofbindingen in benzeen korter en sterker is dan elk van de andere drie. Experimenteel gezien hebben de zes koolstof-koolstofbindingen in benzeen echter dezelfde bindingslengte en dezelfde bindingsenergie., Het Lewis-diagram geeft geen bevredigende verklaring voor de structuur en binding van benzeen.
een attribuut van moleculen waarvan het klassieke Lewis-diagram niet consistent is met de waargenomen eigenschappen is dat andere geldige Lewis-diagrammen voor hen kunnen worden gegenereerd. Voor benzeen kan een extra Lewis-diagram worden getekend.

echter, geen van hen is consistent met de waargenomen eigenschappen van benzeen en geeft benzeen daarom niet correct weer.,
Resonantietheorie is een poging om de structuur van een soort, zoals het nitraation of benzeen, te verklaren, waarvan geen Lewis-diagram consistent is met de waargenomen eigenschappen van de soort. Het grote voordeel van de resonantietheorie is dat, hoewel gebaseerd op rigoureuze wiskundige analyse, de resonantietheorie met succes kan worden toegepast met een beroep op weinig of geen wiskunde. De resonantietheorie wordt hieronder uitgelegd aan de hand van het nitraation als voorbeeld.
volgens de resonantietheorie is de structuur van het nitraation niet 1 noch 2 noch 3, maar het gemiddelde van alle drie, gewogen met stabiliteit., Lewis diagrammen 1, 2 en 3 worden resonantievormen, resonantiestructuren of resonantie-bijdragers van het nitraat-ion genoemd. De structuur van het nitraat-ion wordt gezegd dat het een resonantiehybride is of simpelweg een hybride van resonantievormen 1, 2 en 3. Wanneer het nodig is om de structuur van het nitraat-ion te tonen, worden resonantievormen 1, 2 en 3 getekend, verbonden door een tweekoppige pijlen.,
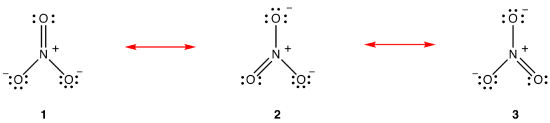
De drie resonantievormen van het nitraation 1, 2 en 3 zijn identiek, zodat ze dezelfde stabiliteit hebben en daarom gelijkelijk bijdragen aan de hybride., Aangezien de exacte mate waarin elke resonantievorm van het nitraation bijdraagt tot de hybride bekend is, kunnen de bindingsvolgorde van elke stikstof-zuurstofbinding evenals de formele lading op elk zuurstofatoom in de hybride gemakkelijk worden bepaald:
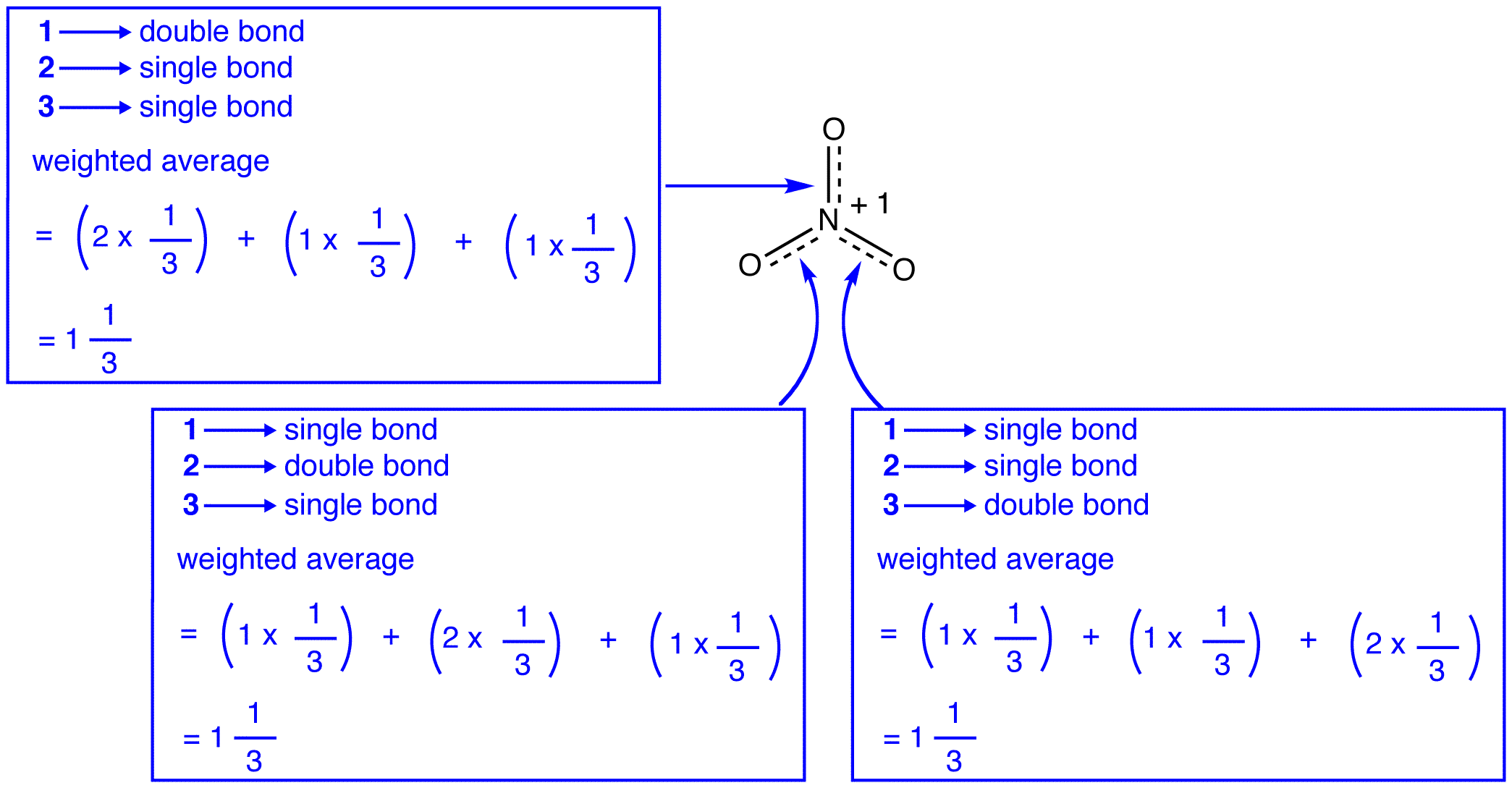
volgens de resonantietheorie is elke binding in het nitraation één en een derde van een binding, hetgeen overeenkomt met de waarneming dat de drie bindingen in het nitraation dezelfde bindingslengte hebben en de dezelfde bindingsenergie.,
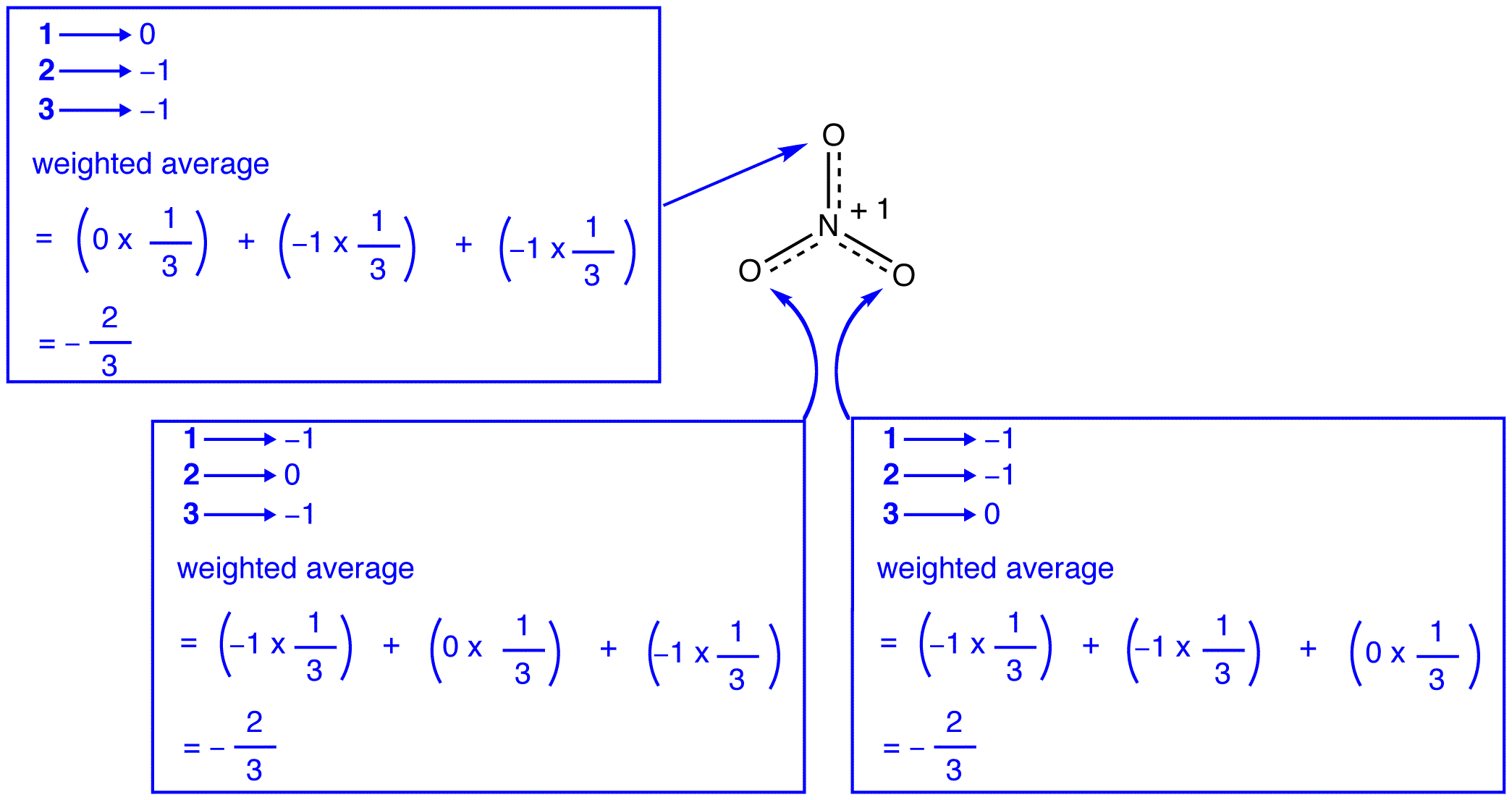
volgens de resonantietheorie heeft elk zuurstofatoom in het nitraation een formele lading van -2/3, wat, in combinatie met het feit dat de drie stikstof-zuurstofbindingen identiek zijn, overeenkomt met de waarneming dat de drie zuurstofatomen in het nitraation niet van elkaar te onderscheiden zijn. In elke resonantievorm van het nitraat-ion zijn er twee \(\pi\) elektronen, die slechts door twee atomen worden gedeeld. Een elektron dat slechts door twee atomen wordt gedeeld zou gelokaliseerd zijn., Zo zijn de twee\ (\pi\) elektronen in elke resonantievorm van het nitraation gelokaliseerd. Het nitraation, vertegenwoordigd door de hybride, heeft twee \(\pi\) elektronen:
- # elektronen in één \(\pi\) binding = 2
- # elektronen in een derde van een \(\pi\) binding = 2/3
- # elektronen in drie van hen = 3 x (2/3) = 2
de twee \(\pi\) elektronen in het nitraation worden gedeeld door een totaal van vier atomen, één stikstofatoom en drie zuurstofatomen. Een elektron gedeeld door meer dan twee atomen wordt gezegd te worden gedelokaliseerd. Zo worden de twee \(\pi\) elektronen in het nitraation gedelokaliseerd., Delokalisatie van\ (\pi\) elektronen in het nitraation vereist dat de vier atomen zich op hetzelfde vlak bevinden, waardoor laterale overlapping van de p-orbitalen erop mogelijk is.,

indien de energie van het nitraation het gewogen gemiddelde was van de energieën van de drie resonantievormen, moet deze gelijk zijn aan de energie van een van de drie identieke resonantievormen:

indien de energie van de hybride gelijk is aan die van een resonantievorm, aangezien alle chemische entiteiten (elementaire deeltjes, atomen, moleculen, enz.,) natuurlijk de neiging om in de laagst mogelijke energietoestand, zou er geen voordeel voor het nitraat ion te bestaan als de hybride; het zou gewoon kunnen bestaan als een resonantie vorm. Aangezien het nitraation bestaat als hybride, niet als resonantievorm, kan worden afgeleid dat de energie van de hybride lager is dan die van een van de resonantievormen.

volgens de resonantietheorie is de energie van een molecuul dan lager dan die van de laagste-energetische resonantievorm., Aangezien het nitraation een lagere energie heeft en daardoor stabieler is dan een van zijn resonantievormen, wordt gezegd dat het nitraation resonantiestabiliserend is.
veel voorkomende misvattingen
Er zijn twee misvattingen over resonantietheorie onder beginnende studenten, waarschijnlijk als gevolg van de letterlijke interpretatie van het woord resonantie. Ze worden hieronder beschreven, met als voorbeeld het nitraation.
misvatting 1: het nitraation bestaat een moment als resonantievorm 1 en verandert dan ofwel in resonantievorm 2 ofwel in resonantievorm 3, die interconverteren of terugkeren naar 1.,

de structuur van het nitraation is niet 1 noch 2 noch 3, maar de hybride en verandert niet met de tijd, tenzij het een reactie ondergaat.misvatting 2: In een monster van nitraationen bestaat op een gegeven moment een derde van de ionen als resonantievorm 1, een derde als resonantievorm 2 en de resterende derde als resonantievorm 3.

In een monster van nitraationen hebben alle ionen op een gegeven moment dezelfde structuur, namelijk de hybride.,de klassieke analogie die gebruikt wordt om deze twee misvattingen te verduidelijken is de mule (Morrison, R. T.; Boyd, R. N. Organic Chemistry, fifth edition; Allyn and Bacon: Boston, 1987, pg. 373). Biologisch gezien is een muilezel een hybride van een paard en een ezel. Dit betekent niet dat een muilezel een moment op een paard lijkt en dan verandert om op een ezel te lijken. Het uiterlijk van een muilezel is een combinatie van die van een paard en die van een ezel en verandert niet met de tijd. Het betekent ook niet dat in een kudde sommige muilezels op een paard lijken en de anderen op een ezel., In een kudde hebben alle muilezels hetzelfde uiterlijk, wat een combinatie is van een paard en een ezel. De zwakte van deze analogie is dat paarden en ezels bestaan, terwijl resonantievormen strikt hypothetisch zijn. Een betere analogie, Geciteerd in Morrison en Boyd, is de neushoorn. Bij het zien van een neushoorn, zou men het kunnen beschrijven als de hybride van een draak en een eenhoorn, twee wezens die niet bestaan.