Mål
- Definere korrosjon
- Liste over noen av de metoder som brukes for å hindre eller redusere korrosjon
Korrosjon er vanligvis definert som nedbrytning av metaller på grunn av en elektrokjemisk prosess. Dannelsen av rust på jern, anløpe på sølv, og de blå-grønn patina som utvikler på kobber er alle eksempler på korrosjon., Den totale kostnaden for korrosjon i Usa er betydelig, med anslag i overkant av en halv billion dollar i året.
Kanskje de mest kjente eksempel på korrosjon er dannelsen av rust på jern. Jern ruster når det utsettes for oksygen og vann. De viktigste trinnene i rustdannelse av jern synes å innebære følgende (Figur 2). En gang utsatt til atmosfæren, strykejern raskt oxidizes.
elektroner redusere oksygen i luften i sure løsninger.
Det vi kaller rust er hydrert jern(III) oksid, som former når jern(II) ioner reagerer videre med oksygen.,
antall vannmolekyler er variabel, slik det er representert ved x. I motsetning til patina på kobber, dannelsen av rust ikke skape et beskyttende lag, og så korrosjon av jern fortsetter som rust flak av og utsetter friske jern til atmosfæren.
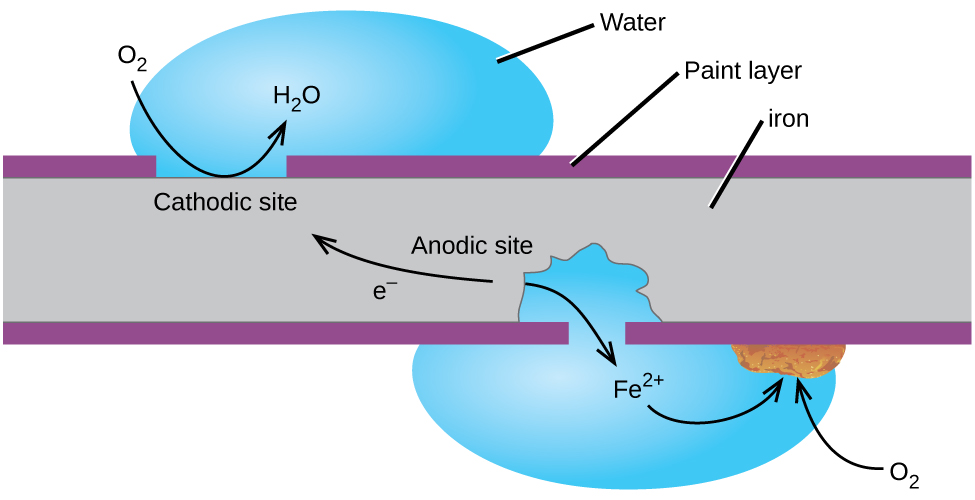
En måte å holde jern fra etsing er å holde det malt. Laget av maling hindrer vann og oksygen som er nødvendig for rust dannelse fra å komme i kontakt med strykejern. Så lenge malingen fortsatt er intakt, strykejern er beskyttet mot korrosjon.,
Andre strategier er blant annet legert jern med andre metaller. For eksempel, rustfritt stål er mest jern med en bit av krom. Krom har en tendens til å samle nær overflaten, der den danner et oksid laget som beskytter jern.
Sink-belagt eller galvanisert jern bruker en annen strategi. Sink er mer lett oksidert enn strykejern fordi sink har en lavere reduksjon potensial. Siden sink har en lavere reduksjon potensial, det er en mer aktiv metall. Dermed, selv om sink belegg er ripete, sink vil fortsatt oksidere før strykejern., Dette tyder på at denne tilnærmingen bør jobbe med andre aktive metaller.
en Annen viktig måte å beskytte metall er å gjøre det katoden i en galvanisk celle. Dette er katodisk beskyttelse og kan brukes til metaller enn jern. For eksempel, den rustdannelse av t-jern lagring tanker og rør kan forebygges eller sterkt redusert ved å koble dem til en mer aktiv metall, for eksempel sink eller magnesium (Figur 3). Dette er også brukt til å beskytte metalldeler i varmtvannsberedere., Den mer aktive metaller (lavere reduksjonspotensial) er kalt offeranoder fordi som de blir brukt opp som de vil føre til rust (oksidere) på anoden. Metall blir beskyttet fungerer som katode, og så ikke oksiderer (rust). Når anoder er riktig overvåket og med jevne mellomrom erstattes, levetid av jern lagertank kan bli sterkt utvidet.
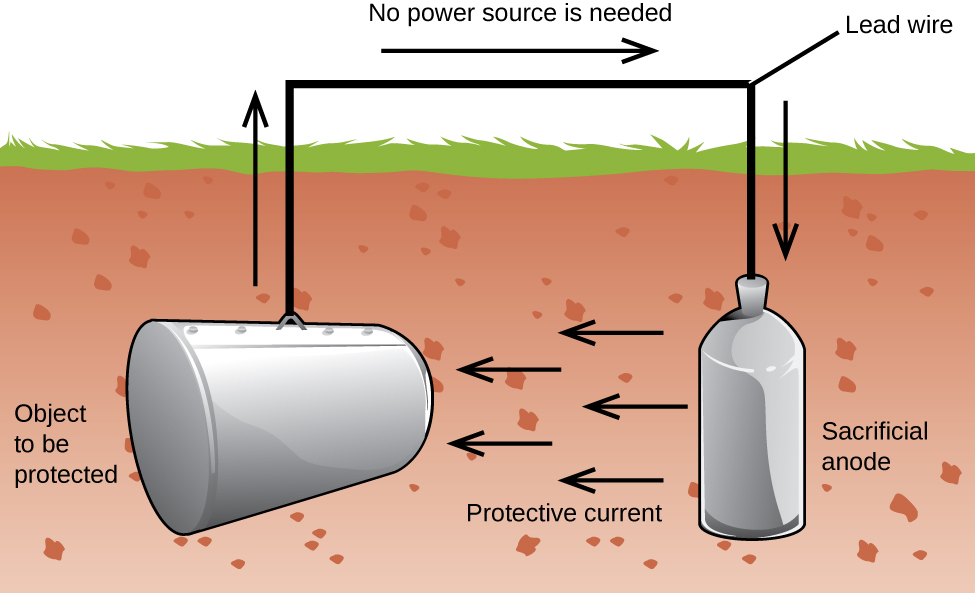
Korrosjon er nedbryting av metall forårsaket av en elektrokjemisk prosess. Store summer av penger er brukt hvert år å reparere effekten av, eller hindre, korrosjon. Noen metaller, som aluminium og kobber, produsere et beskyttende lag når de føre til rust i luften., Den tynne lag som danner seg på overflaten av metall hindrer luft i å komme i kontakt med flere av metall atomer og dermed «beskytter» de gjenværende metallet mot videre korrosjon. Strykejern korroderes (former rust) når de utsettes for vann og oksygen. Rust som danner seg på jern metall flak av, utsette frisk metall, som også korroderes. En måte å forhindre eller bremse, korrosjon er av belegg metall. Belegget hindrer vann og oksygen i å kontakte metall. Maling eller andre belegg vil redusere korrosjon, men de er ikke effektiv når riper., Sink-belagt eller galvanisert jern utnytter det faktum at sink er mer sannsynlig å oksidere enn jern. Så lenge malingen fortsatt er, selv om riper, sink vil oksidere før strykejern. En annen metode for å beskytte metaller er katodisk beskyttelse. I denne metoden, kan en lett oksidert og billig metall, ofte sink eller magnesium (den oppofrende anode), er elektrisk koblet til det metallet som skal beskyttes. Den mer aktive metall er oppofrende anode, og er anoden i en galvanisk celle. «Protected» metal er katoden, og er fortsatt unoxidized., En fordel med katodisk beskyttelse er at den oppofrende anoden kan kontrolleres og skiftes ut ved behov.,
Ordliste
katodisk beskyttelse metode for å beskytte metall ved hjelp av en oppofrende anode og effektivt gjør det metallet som må beskyttes katoden, og dermed forhindre oksidasjon korrosjon nedbryting av metall gjennom en elektrokjemisk prosess galvanisert jern metode for å beskytte strykejern ved å dekke den med sink, som vil oksidere før jern, sink-belagt strykejern oppofrende anode mer aktiv, billig metall som brukes som anode i katodisk beskyttelse; ofte laget av magnesium eller sink
Solutions
Svar til Kjemi Slutten av Kapittel Øvelser
2., Mg Zn
4. Begge eksempler innebære katodisk beskyttelse. Den (offer) anode er det metallet som korroderes (oxidizes eller reagerer). I tilfelle av jern (-0.447 V) og sink (-0.7618 V), sink har en mer negativ standard reduksjonspotensial og slik virker som anode. I tilfelle av jern og kobber (0.34 V), strykejern har mindre standard reduksjonspotensial og så korroderes (fungerer som anode).
6., Mens reduksjonen potensialet til litium ville gjøre det i stand til å beskytte andre metaller, dette potensialet er også en indikasjon på hvordan reaktiv litium er; det ville ha en spontan reaksjon med de fleste stoffer. Dette betyr at litium ville reagere raskt med andre stoffer, selv de som ikke ville oksidere metall forsøker å beskytte. Reaktivitet liker dette betyr at den oppofrende anode ville være tømt raskt og må skiftes ut ofte. (Valgfritt ekstra grunn: brannfare i nærvær av vann.)