Innledning
Kjernefysiske faktor kappa B (NF-kB) er en gammel protein transkripsjonsfaktor (Salminen et al. 2008) og anses som en regulator av medfødt immunitet (Baltimore, 2009). NF-kB signaliserer veien lenker patogene signaler og mobile fare signaler dermed organisering mobil motstand mot invaderende patogener., Faktisk, en mengde studier har vist NF-kB er en nettverkshub ansvarlig for komplekse biologiske signalering (Albensi og Mattson, 2000; Kaltschmidt og Kaltschmidt, 2009; Karin, 2009). For dette formål, NF-kB har vært en hypotese om å bli en mester regulator av evolusjonært bevart biokjemiske kaskader (Mattson et al., 2000). Andre faktorer er også translocated inn i mitokondriene, og er involvert i modulerende uttrykk (Barshad et al., 2018a), men er ikke fokus for denne gjennomgangen., Formålet med denne gjennomgangen er å forsøke å forstå hvordan NF-kB aktivitet bidrar til mitokondrienes funksjon. Det er antatt leseren allerede har en forståelse av grunnleggende mitokondrie biologi. I tilfelle av videre studier, leseren er referert til mange gode studier og vurderinger på mitokondrie struktur og funksjon (Hall, 1979; Fox, 1982; Roger og Silberman, 2002; Henze og Martin, 2003; Conradt, 2006; Ettema, 2016; Wang og Youle, 2016; Barshad et al., 2018b).,
NF-kB Aktivering
Kjernefysiske faktor kappa B underenhetene, bestående av NF-kB kompleks, er uttrykt i både nevroner og glia. NF-kB komplekse finnes i en inaktiv tilstand i cytoplasma (Ghosh et al., 1998; Aggarwal et al., 2004; Hayden og Ghosh, 2004) hvor aktivering av NF-kB har blitt godt beskrevet (Li og Karin, 2000; Baud og Jacque, 2008; Israel, 2010). Når stimulert av molekyler som TNFa, eller andre celle stressfaktorer, TNFa binder seg til TNF-reseptorer (Figur 1)., Denne bindende, via flere mellomliggende trinn, fører til et samspill med IkB kinase (IKK) – komplekset, som deretter fører til phosphorylation av IkB, og senere resulterer i IkB ubiquitination og fornedrelse. Når degradert, de resterende NF-kB-dimer (f.eks., p65/p50 underenhetene) translocates til kjernen, hvor det binder seg til DNA konsensus sekvens av ulike mål gener. Den selektivitet av NF-kB svar er basert på flere faktorer (Sen og Smale, 2010) inkludert dimer sammensetning, tidspunkt og celle-type., NF-kB innflytelse på celle overlevelse er også kompliserte og kan være neuroprotective eller proinflammatory, avhengig av typen celle, utviklingsmessige scenen, og patologisk tilstand (Qin et al., 2007).
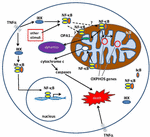
Figur 1. Trasé for Kjernefysisk faktor κ B (NF-kB) signalering i cytoplasma og mitokondrium. NF-kB tri-subunt komplekse (f.eks., p65, p50, IkB – en mulig kombinasjon) som finnes i en inaktiv tilstand i cytoplasma. NF-kB aktivering er igangsatt når molekyler som TNFa binde seg til TNF-reseptorer (forskjellige typer finnes)., Andre eksterne eller interne stimuli kan også aktivere NF-kB. En komplisert signal transduksjon prosessen begynner når TNF-reseptorer er aktivert, IkB kinase (IKK) er til syvende og sist utløst og fører til phosphorylation av IkB, noe som resulterer i IkB ubiquitination og fornedrelse. Når IkB er degradert, de resterende NF-kB-dimer (f.eks., p65/p50 eller p50/p50 subunit kombinasjoner er mulig) translocates til kjernen, hvor det binder seg til DNA konsensus sekvens av mål gener., Av prosesser som ikke er godt forstått, NF-kB komplekse eller NF-kB underenhetene kan også vandre inn i mitokondrium, hvor tyder på det/de opptar intermembrane plass. Når du er inne i mitokondriene, NF-kB er tenkt å samhandle med OXPHOS gener (mitokondrie mtDNA) som fører til uttrykk av proteiner involvert i ulike funksjoner, inkludert mitokondrie dynamics og COX III til forordning (komponent av Komplekse IV)., Bevis antyder også, NF-kB kan fungere som en bryter i mitokondrier og kontrollere balansen mellom bruk av cytoplasmatiske glykolysen og mitokondrie åndedrett i normale celler og kreft. Til slutt, data også peke på reelle apoptotic vei stimulering, hvor NF-kB aktivering i mitokondriene fører til cytokrom c utslipp, og dermed utløser caspase stup og programmerte celledød.,
Organisatorisk, NF-kB er en Rel familie transkripsjonsfaktor og er assosiert med fem gener, NF-kB1, NF-kB2, RELA, RELB, og REL (Chen og Greene, 2004), og disse genene koder for flere proteiner, NF-kB1, NF-kB2, RelA, RelB, og c-Rel, henholdsvis, hvor to av disse proteinene er store forløper proteiner kjent som p105 og p100-at gjennomgå protolyse å bli p50 og p52, henholdsvis. Disse proteinene inneholder REL-homologi domener (RHD) ved deres aminosyre-terminal-regionen; og ENDA regionen består av 2 separate, men tilstøtende domener., Sekvensen mest fjernt fra carboxy-terminal regionen gjør at proteinet binder seg til DNA. En mer indre sekvens kan Rel familie proteiner til dimerize (homo – eller heterodimers) for undertrykkelse av ytringsfriheten via binding av deres tilhørende familien av hemmere, den IkB proteiner (Chen og Greene, 2004). Den siste sekvensen inneholder atomvåpen-lokalisering sekvens (NLS) som blir avslørt når IkB er ubundet av nedbrytning. Den NLS har jobben med å veilede eller tagging aktive proteiner for import inn i cellekjernen (Chen og Greene, 2004; Karin et al., 2004; Barger et al.,, 2005).
Tre av disse proteinene (RelA, RelB, og c-REL) også kode en transactivation domene (TADs) i sin carboxy-terminal regionen. Den TADs tillate disse proteinene til å samhandle med basal transkripsjon apparater, kjent som TATA bindende protein (TBP), transkripsjonsfaktor IIB, samt p300 og cAMP svar element (CREB) bindende protein (CBP) transcriptional co-utløsere (Chen og Greene, 2004)., Bare disse tre proteiner som er i stand til å induserer transkripsjon av sine DNA-kodende regioner, mens den andre proteiner, p50 og p52 homodimers, er i stand til å bruke DNA-bindende områder uten initiering av transkripsjon. Gitt dette, senere 2 homodimers proteiner av p50 og p52 fungere som transcriptional repressors (Chen og Greene, 2004).
p105 og p100-homodimers okkupere DNA-bindende områder dermed blokkere transkripsjon via transkripsjonfaktorer som har TADs (Barger et al., 2005). En tredje form av transcriptional undertrykkelse er på grunn av IkB proteiner., Disse proteinene har flere ankyrin gjentar som sin kjernevirksomhet domene og funksjon ved binding til RHD at maskere NLS (Karin et al., 2004). Uten en aktiv NLS, NF-kB proteiner er begrenset til cytoplasma og er ikke i stand til å vandre inn i kjernen og så transkripsjon er blokkert.
NF-kB Er Funnet i Mitokondriene
I 2001, en studie av Bottero et al. (2001) fant IkBa og NF-kB p65 subunit i subcellular fraksjoner og renset mitokondrier fra Jurkat celler. Jurkat celler er en udødeliggjort cellelinje av human T-lymfocytt-celler som er brukt til å studere leukemi., I Bottero s studie ble det slått fast at IkBa og NF-kB p65 var lokalisert i mitokondrie intermembrane plass. Den mitokondrie intermembrane område er område som eksisterer mellom mitokondrienes indre membran (IMM) og mitokondrienes ytre membran (OMM).
Senere, Cogswell et al. (2003) viste også at NF-kB underenhetene, p50 og p65, og IkBa, ble funnet i mitokondriene. For å avgjøre dette, flere metoder ble brukt for å skaffe bevis, inkludert elektron mikroskopi av deler av U937 celler., U937 celler ble først isolert fra lymfom av en middelaldrende mannlig pasient å studere atferd og differensiering av monocytter. Her Cogswell et al. (2003) var i stand til å visualisere NF-kB p50 og p65 underenhetene og IkBa i indre matrise av mitokondriene. Rotte leveren celler ble også undersøkt i denne studien og p50 subunit og IkBa subunit ble også identifisert. I tillegg, U937 cellene ble stimulert for 1 h med TNFa, en kjent utløse av NF-kB signaliserer veien., I dette eksperimentet, Western blot-analyser i mitokondrie og cytoplasma fraksjoner fant at TNFa behandling forårsaket tap av IkBa i både mitokondrie og cytoplasma lommer av 30 min etter behandling tyder på at IkBa ble redusert. EMSA analyse, en in vitro-analysen som oppdager NF-kB aktivering og ikke-spesifikk binding til DNA sekvenser, ble også gjennomført på protein tatt fra en kjernefysisk ekstrakter fra mitokondrier isolert fra U937 celler stimulert med TNFa., Her er de fast bestemt på TNFa signaliserer førte til økt DNA-bindende aktivitet av NF-kB p50, i protein tatt fra mitokondriene.
Andre studier har også påvist NF-kB i mitokondriene. Disse inkluderer studier (Guseva et al., 2004; Zamora et al., 2004) i menneskelig fibroblast HT1080 celle linjer, menneskelige prostata LNCaP og PC3 celle linjer, og HeLa-celler. I LNCaP-celler, mitokondrier NF-kB p50 og p65 underenhetene ble funnet bundet til mitokondrie DNA (mtDNA)., Tatt sammen, og disse studiene viser bevis for NF-kB signalering i mitokondrier og at NF-kB regulerer mitokondrie mRNA uttrykk (se NF-kB og mitokondrie genuttrykk avsnittet nedenfor).
NF-kB-Kontroller Mitokondrie Dynamics
Det er flere proteiner som er involvert i dynamics (fisjon og fusjon) og morfologi av mitokondrier (Karbowski og Youle, 2003; Olichon et al., 2006; Brooks og Dong, 2007; Song et al., 2008; Autret og Martin, 2010; Silva et al., 2013; Sinha og Manoj, 2019). En av disse er optisk atrofi 1 protein (OPA1) (Olichon et al.,, 2006; Garcia et al., 2018; Lee og Yoon, 2018). Studier har antydet at OPA1 er en regulator av mitokondrienes indre membran fusjon og også mitokondrie cristae ombygging (Cipolat et al., 2006). Nylig Laforge et al. (2016) viste at fraværet av IKKa hadde en innvirkning på OPA1 uttrykk i mitokondrier og på mitokondrie morfologi.
Overraskende, i en nyere studie av Nan et al. (2017), TNFa reseptor 2 (TNFR2) stimulering ble funnet å fremme mitokondrie fusion via NF-kB-avhengige aktivering av OPA1 uttrykk i cardiac myocytes., Viktigere, TNFR2 aktivering i denne studien er beskyttet cardiac myocytes mot stress ved upregulating OPA1 uttrykk. Ved administrering av lave konsentrasjoner av eksogene TNFa (0.5 ng/mL) før iskemi-reperfusion dukket opp for å forbedre celle overlevelse, mens høyere konsentrasjoner (10-20 ng/mL) førte til toksiske effekter i celler.
NF-kB og Apoptosis i Mitokondriene
Mitokondrier rolle i programmerte celledød, eller apoptosis har vært kjent i lengre tid (Grønn og Reed, 1998; Wang og Chen, 2015)., Den mest viktig rolle for mitokondriene er produksjon av ATP, men den nest viktigste funksjonen til mitokondriene er sannsynligvis i å kontrollere celledød. Hvordan fungerer mitokondrium gjøre dette? Hvis mitokondrium mislykkes i å utløse celledød, kreft er ofte konsekvensen. Så, for å regulere celledød, mitokondrier integrere signaler fra en rekke kilder, som er kjent som indre trasé av apoptosis. Komponenter av NF-kB aktivitet synes å være en av disse signalene, selv om TNFa, en aktivator av NF-kB, er en del av en ytre vei av apoptosis., Ytre trasé (død reseptor-mediert) er initiert utenfor cellen, mens indre trasé av apoptosis er mediert og utløst i mitokondriene.
I en nyere studie av Pazarentzos et al. (2014), IkBa ble funnet å utøve pro-apoptotic aktivitet som det hemmet anti-apoptotic NF-kB. I de fleste celler, aktivering av NF-kB fører til nedstrøms mål genuttrykk som utløser celledød motstand (Luo et al., 2005). I denne studien ble det vist at en roman apoptosis funksjon var grunn til å IkBa, den subunit som hemmer NF-kB aktivisering. Pazarentzos et al., (2014) fant at IkBa lokaliserer til OMM hvor det er i samspill med en spenning som er avhengige anion-kanal (VDAC) og mitokondrie hexokinase II (HKII) for å stabilisere denne komplekse og hindre Bax-mediert cytokrom c utgivelsen for apoptosis. Bax er medlem av Bcl-2 familie av proteiner, noe som har vist seg å være regulatorer av programmerte celledød (Karbowski et al., 2006).
Andre studier har også antydet NF-kB rolle i mer direkte regulering apoptosis i mitokondrie. I en studie av Liu et al., (2004), hemming av NF-kB alene i makrofager resulterte i utgivelsen av cytokrom c. Husker at cytokrom c er ansvarlig for skytteltrafikk elektroner fra Kompleks III Kompleks IV og at utgivelsen av cytokrom c i cytoplasma, en aktivator av caspases, er et viktig skritt i å utløse apoptosis.
NF-kB og Mitokondrie Åndedrett
Kjernefysiske faktor kappa B har blitt vist i mange studier for å fremme tumorigenesis. Hvordan dette skjer ikke var helt klart. I en banebrytende studie av Mauro et al., (2011), NF-kB ble funnet å upregulate mitokondrie åndedrett i colon brystkreft celler. Her er de etablert på at denne funksjonen av NF-kB undertrykker Warburg effekt. Husker at Warburg effekt (Vander Heiden et al., 2009) beskriver den observasjon at kreftceller har en tendens til å favorisere metabolisme av glykolysen, snarere enn av den mer effektiv oksidativt phosphorylation veien. Så i denne studien forfatterne bestemt at NF-kB organiserer et nettverk av energi metabolisme ved å kontrollere balansen mellom glykolysen utnyttelse og mitokondrie åndedrett., Interessant nok fant de en rolle for NF-kB i metabolsk tilpasning i normale celler og kreft. Deres resultater er videre foreslått at å undertrykke mitokondrie metabolisme i etablerte kreft celler ved hemming av NF-kB og metformin reduserer tumorigenesis.
NF-kB og Mitokondrie genuttrykk
Kjernefysiske faktor kappa B er en kjent regulator av genuttrykk – både negativt og positivt (Mattson et al., 2000). Men, hvordan NF-kB regulerer eller påvirker atomvåpen-kodet mitokondrie genuttrykk er mindre forstått., Menneskelige mtDNA har 37 gener som koder for 13 polypeptides. Det har vist seg at mt-dna gener koden for mange av de underenhetene av alle 5 komplekser av elektrontransportkjeden (ETC), 2 rRNAs, og 22 tRNAs. Men, de fleste ETC underenhetene er kodet av kjernefysiske DNA, som kan være påvirket av NF-kB aktivitet (Calvo et al., 2016).
For eksempel, det har vært hevdet (Cogswell et al., 2003) som NF-kB vei, kan ha negativ regulere mitokondrie genuttrykk forbundet med COX III subunit., COX III subunit er kodet av mtDNA og er en del av Kompleks IV i mitokondrie ETC. Det fungerer som en katalysator subunit i Komplekse IV, som er de komplekse forbundet med mitokondrie oksygen forbruk. I en studie av Cogswell et al. (2003), modulering av NF-kB aktivering resultert i tap av uttrykk av både COX III og cytokrom b mRNA. Andre studier støtter en rolle for NF-kB regulering ekstra mitokondrie gener, slik som COX jeg, og Cytb (Psarra og Sekeris, 2008, 2009; Barshad et al., 2018b)., I tillegg, NF-kB p65 subunit reduserte nivåer av mtDNA-kodet CytB mRNA, muligens ved binding til D-loop i humane celler i fravær av p53 (Johnson et al., 2011). Samlet sett antyder disse resultatene at NF-kB-signaler kan påvirke enzymatisk aktivitet av luftveiene ETC komplekser.
NF-kB Formidler Aß-Indusert Dysfunksjon i Mitokondriene
Alzheimers sykdom (AD) er forbundet med å bygge opp Aß plaketter og/eller utseende av neurofibrillary floker (NFTs) i visse hjernen regioner (Duyckaerts et al., 2009)., Imidlertid uenighet eksisterer rundt om Aß er en causative agent ANNONSE eller hvis Aß er rett og slett forbundet med aldring. Samler bevis (Aliev et al., 2009; Correia et al., 2012; Cadonic et al., 2016; Cardoso et al., 2017; Djordjevic et al., 2017) også peker nå til endringer i hjernens metabolisme drevet av mitokondrie dysfunksjon som en prosess som er sentrale for mange av alder-relaterte nevrodegenerativ lidelser inkludert ANNONSEN. Legge til dette bevis, det er også nedskrivninger i enzymatisk aktivitet av protein komplekser av ETC, og endringer i antioksidant enzymatisk aktivitet (Kolosova et al.,, 2017) i ANNONSEN. Særlig Kompleks IV aktivitet har vist seg å være negativt påvirket i ANNONSE (Mutisya et al., 1994).
I en nyere studie av Shi et al. (2014), ble det funnet at Aß nedsatt mitokondrienes funksjon via NF-kB-signalering. Videre, Shi et al. (2014) viste her at Aß redusert uttrykk av COX III subunit via NF-kB veien., Viktigere, for å eliminere muligheten for at IkBa var phosphorylated av Aß i cytoplasma (og deretter transportert inn i mitokondriene), isolerte mitokondrier ble inkubert med Aß i nærvær (eller fravær) av en NF-kB blokker, nemlig BAY11-7082. Her fant de Aß indusert phosphorylation og nedbrytning av IkBa i isolerte mitokondrier.
Disse funnene også har viktige implikasjoner for AD behandling som demonstrert av nyere studier av Snow et al. (2018), og som er vist i andre beslektede studier (Djordjevic et al., 2017; Adlimoghaddam et al.,, 2019) som tyder på målretting NF-kB signalering i mitokondriene kan ha terapeutisk verdi. For eksempel, i Snow et al.’s studie, kreatin – en kjent modulator av mitokondrienes funksjon (Tarnopolsky og Beal, 2001), ble det vist seg å øke og positivt forandre protein nivåer av CaMKII, PSD-95, og Komplekse 1 underenhetene i kreatin matet mus, mens NF-kB hemmende IkB subunit ble redusert. For ytterligere lesing på kreatin er potensielle terapeutiske effekt på mitokondrienes funksjon og i mitokondrie lidelser eller andre nevrologiske lidelser se studier og vurderinger av Matthews et al., (1998), Klivenyi et al. (1999), Tarnopolsky og Beal (2001), Hersch et al. (2006), Rodriguez et al. (2007) og Beal (2011).
NF-kB Rolle i Betennelse og Mitokondrie Metabolisme
Økende data (Lamas et al., 2003; Mauro et al., 2011; Moretti et al., 2012) er noe som tyder på at NF-kB signalering, som er en mellommann av inflammatoriske prosesser, er også fungerer som en regulator og integrator med energi metabolismen. I en nyere studie av Zhong et al. (2016), NF-kB ble vist å begrense inflammasome aktivering via eliminering av skadet mitokondrier., Overraskende, NF-kB dukket opp både prime NLRP-3 inflammasome for aktivering og også forhindret overdreven betennelse og behersket NLRP-3 inflammasome aktivering, selv om mekanismen for tilbakeholdenhet var dårlig definert. Her ble det spekulert på at i tillegg til NF-kB være en aktivator av inflammatorisk gener, det fungerte også i denne studien ved å begrense NLRP3 inflammasome aktivering og IL-1β produksjon. Videre ble det funnet at p62 induksjon var ansvarlig for inflammasome hemmende aktivitet av NF-kB., Det ser ut til at NF-kB kan begrense sin egen betennelse i makrofager ved å fremme p62 mediert fjerning av skadet mitokondrier (mitophagy) etter makrofager samhandle med ulike NLRP3 inflammasome utløsere.
Konklusjon
Over 10 år siden, NF-kB ble oppdaget i mitokondriene. Overraskende, for en så viktig transkripsjonsfaktor, lite fremgang har blitt gjort i forhold til å avdekke spesifikke roller for NF-kB som påvirker mitokondrium., Noen studier, som beskrevet ovenfor, må gi bevis for NF-kB i mitokondrie dynamics, apoptosis -, åndedretts-kontroll, genuttrykk, og mekanismer for sykdom (Figur 1). Imidlertid, duplisering av disse resultatene og generell validering er fortsatt nødvendig ved andre laboratorier. Noen ytterligere innsikt kan være hentet fra det faktum at andre transkripsjonfaktorer å ha effekter på kjernefysiske gener, slik som AP-1, p53, CREB, c-Myc, Wnt13, Dok-4, HMGA1, og c-Src har også blitt oppdaget i mitokondriene (Psarra og Sekeris, 2008)., Det som er interessant er bindende områder i mitokondrie genom (homologe til deres bindende områder i den kjernefysiske DNA) for noen av disse faktorene har blitt fastsatt (Psarra og Sekeris, 2008), der roller for mitokondrie transkripsjon og apoptosis er mistenkt og vise noen generelle mønstre av aktivitet. For eksempel, en man kan hevde at noen av disse faktorene (NF-kB, CREB, og AP-1) binder seg til mitokondrie genomer og det meste dempe mitokondrie genuttrykk (Blumberg et al., 2014), mens det å ha stimulerende effekt på kjernefysiske gentranskripsjon., Imidlertid klart mer arbeid er nødvendig for å ikke bare finne presis roller av aktivitet, men også for å finne ut om generelle mønstre av aktivitet virkelig eksisterer.
Etter kartlegging denne litteraturen, blir det også tydelig at NF-kB rolle i regulering av mitokondrie åndedrett har vidtrekkende konsekvenser, og viser et nivå av kompleksitet som ikke tidligere er verdsatt. For eksempel, Mauro et al. (2011) data etablere en rolle for NF-kB i metabolsk tilpasning i normale celler og i kreft, og foreslår også at konsekvensene for annen sykdom tilstander som AD., Videre, gitt at NF-kB kan begrense sin egen betennelse som vist ved Zhong et al. (2016), det er ikke bare overraskende, men videre eksemplifiserer kompleksiteten av NF-kB signalering i mitokondrienes funksjon.
I denne anmeldelsen, studier ble kartlagt på NF-kB rolle i mitokondrienes funksjon, og det ser ut til at forskning på dette området er økende. Kompliserende resultatene er om observasjon at flere faktorer spiller lignende roller i mitokondrienes funksjon og så detaljerte studier som er spesifikke for hver faktor er nødvendig., I konklusjonen, kan vi på nytt stille spørsmålet – Hva er NF-kB gjør i og for mitokondrie? Den umiddelbare og forkortet svar ville være for mye!
Forfatter Bidrag
forfatteren er opprettet emnet og skrev manus.
Midler
Dette arbeidet ble støttet av midler fra Canadian Institutes of Health Research (CIHR), Kanadiske Landbruket Partnerskap (CAP), St. Boniface Hospital Research Foundation, Alzheimers sykdom Society of Manitoba, Forskning Manitoba, Den Ærede Douglas og Patricia Everett, og Royal Canadian Egenskaper Begrenset Endowment Fund.,
interessekonflikt Uttalelse
forfatteren erklærer at forskningen ble gjennomført i fravær av kommersielle eller finansielle forhold som kan oppfattes som en potensiell interessekonflikt.
Erkjennelsene
forfatteren ønsker å takke Dr. Grant Luke for en gjennomgang av manuskriptet.
Hayden, M. S., og Ghosh, S. (2004). Signalering for å NF-kappaB. Gener Dev. 18, 2195-2224.
PubMed Abstrakt | Google Scholar
Wang, X. og Chen, X. J. (2015)., En cytosolic nettverk undertrykke mitokondrier-mediert proteostatic stress og celledød. Arten 524, 481-484. doi: 10.1038/nature14859
PubMed Abstrakt | CrossRef Full Tekst | Google Scholar