Brønsted-Lowry Teori om Syrer og Baser
Brønsted-Lowry teori syre og baser tok Arrhenius definisjon ett skritt videre, som et stoff ikke lenger trengte å være, som består av hydrogen (H+) eller hydroxide (OH-) ioner for å bli klassifisert som en syre eller base. For exmapl, bør du vurdere følgende kjemiske ligningen:
\
- En Brønsted-Lowry acid er et proton (hydrogen ion) som donor.
- En Brønsted-Lowry base er et proton (hydrogen ion) som godkjenner.,
I denne teorien, en syre er et stoff som kan utløse et proton (som i Arrhenius teori) og en base er et stoff som kan akseptere et proton., En grunnleggende salt, slik som Na+F-, genererer OH – ioner i vannet ved å ta protoner fra vann selv (for å gjøre HF):
\
- Syre dissosiasjon
\
- Syre Ionisering Konstant:
\}{}\]
- Base dissosiasjon:
\
- Base Ionisering Konstant
\}{}\]
fastsettelse av et stoff som en Brønsted-Lowery syre eller base kan bare gjøres ved å observere reaksjonen. I tilfelle av HOH det er en base i det første tilfellet og en syre i det andre tilfellet.,
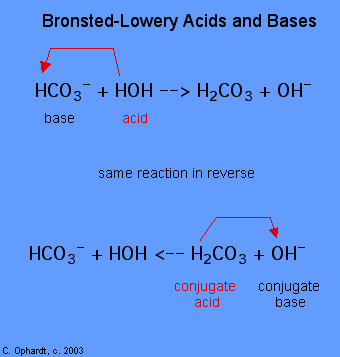
for Å finne ut om et stoff er en syre eller en base, telle hydrogens på hvert enkelt stoff før og etter reaksjonen. Hvis antall hydrogens har sunket at stoffet er syre (donerer hydrogen ioner). Hvis antall hydrogens har økt som stoffet er base (aksepterer hydrogen ioner). Disse definisjonene er vanligvis brukt til reaktantene på venstre side. Hvis reaksjonen er sett i revers en ny syre og base kan identifiseres., Stoffene på høyre side av ligningen er kalt konjugat syre og kobling base i forhold til dem på venstre side. Legg også merke til at den opprinnelige syre svinger i konjugat base når reaksjonen er over.
Merk
Syrer er Proton Givere og Baser er Proton Akseptorer
For en reaksjon for å være i likevekt en overføring av elektroner behov for å oppstå. Syren vil gi et elektron unna, og basen vil motta elektronet. Syrer og Baser som jobber sammen på denne måten kalles en kobling par består av konjugat syrer og kobling baser.,
\
En står for Sure sammensatte og Z står for en Grunnleggende sammensatt
- En Donerer H å danne HZ+.
- Z Aksepterer H fra En som former HZ+
- En – blir konjugat base for HA og i motsatt reaksjon det aksepterer en H fra HZ på å gjenskape HA for å forbli i likevekt
- HZ+ blir en kobling syre av Z, og i motsatt reaksjon det donerer en H å A – å gjenskape Z for å forbli i likevekt