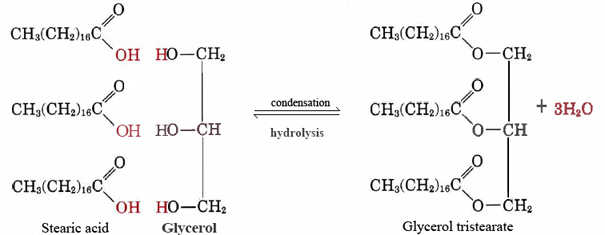
Et godt eksempel på en upolar lipid er nøytralt fett glyserol tristearate. Dette mest vanlige form av animalsk fett fungerer som et lager for energi og som isolasjon mot varmetap. På et molekylært nivå det er konstruert av tre molekyler av stearinsyre og en av glyserol:
 (1)
(1)
mange upolare lipider kan bli laget ved å kombinere ulike long – chain-syrer med glyserol., Fordi disse syrer ble opprinnelig utvunnet fra fett, de er samlet referert til som fettsyrer.
legg Merke til at for hver stearic eller andre fettsyrer molekyl som kombinerer med en av —OH grupper av glyserol, et molekyl vann er gitt ut, og så reaksjonen er en kondens. Det viser seg at svært mange viktige biologiske molekyler er satt sammen av kondens reaksjoner under vann er gitt av. Det motsatte av Eq. (1), der vann reagerer med et stort molekyl og deler den opp i mindre biter, kalles hydrolyse., Ved å utføre hydrolyse levende organismer kan bryte ned molekyler som er produsert av andre arter. Den enkle byggeklosser fått denne måten kan da bli saman av kondens reaksjoner til å danne strukturer som passer til deres nye vert.
Ved å kontrast med glyserol tristearate funnet i dyr, vegetabilsk fett inneholder flere doble obligasjoner i sine lange hydrokarbon kjeder. Dette polyunsaturation introduserer «knekk» i hvilke kjeder på grunn av barrieren for å rotasjon og 120° vinkler forbundet med doble obligasjoner., Derfor er det vanskeligere å justere kjedene side ved side (se Figur \(\PageIndex{1}\) ), og umettet fett ikke pakke sammen så lett i en krystall gitter. Som sant var med alkaner, kjede lengde avgjør også om et fett er flytende eller fast, og hvor smeltepunkt oppstår.
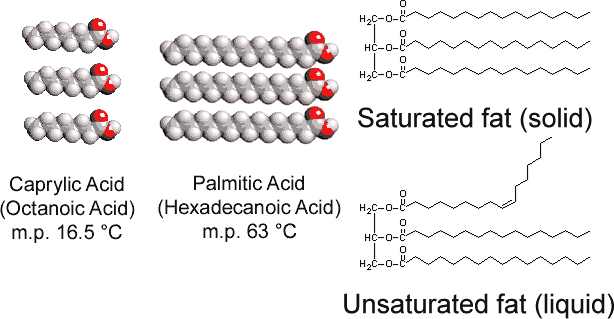
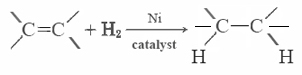
Mest umettet fett (som mais olje) er væsker ved vanlige temperaturer, mens mettet fett (som smør) er faste stoffer. Vegetabilske oljer kan konverteres ved hydrogenering til forbindelser som er faste stoffer. Denne prosessen innebærer å legge H2 catalytically til å doble obligasjoner:
Hydrolyse av fett er viktig i produksjon av såper., Det kan være fremskyndes ved tillegg av en sterk base som NaOH eller KOH, i hvilket tilfelle reaksjon kalles forsåpning. Siden forsåpning krever at pH i reaksjonsblandingen være høy, fatty acid som er produsert vil ta avstand til sin anion. Når glyserol tristearate er saponified med NaOH for eksempel, sodium stearate, en relativt vannløselige stoffet, og en vanlig såpe, er dannet.
evne til såper til rent for fett og olje fra skitne overflater er et resultat av de to hydrofobe-hydrofile strukturer av sine molekyler., Den stearat ion, for eksempel, består av en lang upolare hydrokarboner kjede med en svært polar —COO– gruppe i den ene enden.
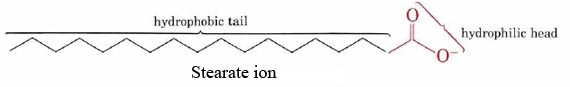
Den hydrofobe hydrokarbon-kjeden prøver å unngå kontakt med vandige media, mens den anioniske gruppe lett plass til den dipol attraksjoner og hydrogen obligasjoner av vannmolekyler.
De to viktigste måtene for at hydrofobe deler av stearat ioner kan unngå vann er å klynge sammen på overflaten eller for å løse opp i en liten mengde olje eller fett (se Figur \(\PageIndex{2}\) ).,
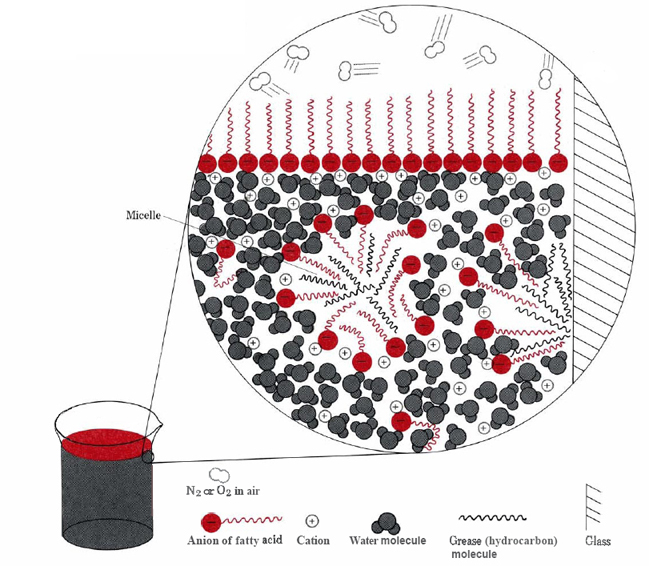
I sistnevnte tilfelle hydrofile hoder av såpe molekyler kontakt vannet utenfor fett, og danner en struktur som er kjent som en micelle. Siden outsides av micelles er negativt ladet, vil de frastøte hverandre, og forhindre at fett dråper fra å rekombinere., Fett er derfor suspendert (emulsified) i vann og kan vaskes enkelt bort.
Naturlig såpe, for eksempel sodium stearate, ble opprinnelig laget i hjemmet ved oppvarming animalsk fett med tre aske, som inneholdt pottaske, K2CO3. Store mengder er fortsatt produsert industrielt, men til en betydelig grad såper har blitt erstattet av vaskemidler. Dette er en konsekvens av uønsket atferd av såper i hardt vann. Kalsium, magnesium og andre hardt vann kationer danne uløselige forbindelser når kombinert med anioner av fettsyrer., Dette gir scummy svikter og hindrer såpe molekyler fra emulsifying fett med mindre et stort overskudd brukes.
Vaskemidler som alkylbenzenesulfonates (ABS) og lineær alkylbenzenesulfonates (LAS) har strukturer svært lik sodium stearate, bortsett fra at de belastet gruppe i deres hydrofile hoder er —SO3– koblet til et benzen ringen. ABS vaskemidler har også metyl (CH3) grupper forgrening av deres hydrokarbon kjeder.,
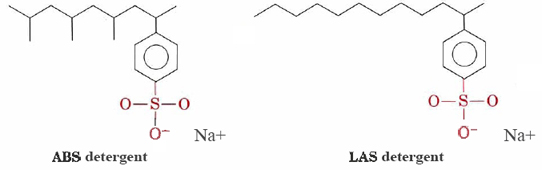
Slike molekyler ikke bunnfall med hardt vann kationer og derfor er mer egnet for maskin vask av klær. LAS vaskemidler erstattet ABS under midten av nitten-sekstitallet, da det ble oppdaget at sistnevnte var ikke biologisk nedbrytbart. De var forårsaker elver og til og med vann fra springen til å bli dekket med vaskemiddel såpeskum og skum. Tilsynelatende enzymer i mikroorganismer som hadde utviklet seg til å bryte ned unbranched hydrokarbon kjeder i naturlig fett og fettsyrer var ute av stand til å fordøye de forgrenede kjeder av ABS-molekyler., LAS vaskemidler, selv om produsert av mennesker, etterligne strukturer av naturlig forekommende molekyler og er biologisk nedbrytbare.