Innledning
Elektroner har ingen fast stilling i atomer, stoffer og molekyler (se bilde nedenfor), men har sannsynligheten for å bli funnet i visse områder (orbitals). Resonans former illustrere områder av høyere sannsynligheter (elektron tettheter). Dette er som å holde hatten på enten høyre eller venstre side. Begrepet Resonans brukes når det er to eller flere muligheter tilgjengelig., Kjemikere bruker Lewis diagrammer for å skildre struktur og binding av covalent enheter, for eksempel molekyler og polyatomic ioner, heretter, molekyler. Lewis diagram for mange et molekyl, er imidlertid ikke i overensstemmelse med den observerte egenskaper av molekylet.
Eksempel \(\PageIndex{1}\): Nitrat-Ion –
– >
nitrat ion, i henhold til sin Lewis diagram, har to typer av nitrogen-oksygen obligasjoner, en dobbel binding og to enkle obligasjoner, noe som tyder på at en nitrogen-oksygen bond i nitrat ion er kortere og sterkere enn hver av de andre to., Også, Lewis struktur tilsier, med hensyn til formelle ansvaret, at det er to typer av oksygen atomer i nitrat ion, en formelt nøytrale og hver av de to andre lager en formell ladning på -1. Eksperimentelt, men de tre nitrogen-oksygen obligasjoner i nitrat ion har samme bånd lengde og samme bond energi, og de tre oksygen atomer er umulig å skille. Lewis diagrammet ikke klarer å forklare struktur og binding av nitrat ion tilfredsstillende.
To ekstra Lewis-diagrammer kan være trukket for nitrat ion.,
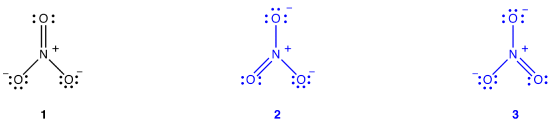
Imidlertid, ingen av dem er i samsvar med den observerte egenskaper av nitrat-ion og er derfor ikke riktig bilde av den nitrat ion.
Eksempel \(\PageIndex{2}\): Benzen
Benzen, i henhold til sin Lewis diagram, har to typer karbon-karbon obligasjoner, tre doble obligasjoner og tre enkelt obligasjoner, noe som tyder på at hver av de tre karbon-karbon obligasjoner i benzen er kortere og sterkere enn hver av de andre tre. Eksperimentelt, men de seks karbon-karbon obligasjoner i benzen har samme bånd lengde og samme bond energi., Lewis diagrammet ikke klarer å forklare struktur og binding av benzen på en tilfredsstillende måte.
Et attributt av molekyler som den klassiske Lewis diagrammet er ikke i overensstemmelse med den observerte egenskaper er at andre gyldig Lewis diagrammer kan genereres for dem. En ekstra Lewis diagrammet kan bli trukket for benzen.

Imidlertid, ingen av dem er i samsvar med den observerte egenskaper av benzen og derfor ikke riktig bilde av benzen.,
Resonans teori er et forsøk på å forklare strukturen av en art, som nitrat-ion-eller benzen, ingen Lewis diagram som er i samsvar med den observerte egenskaper av arter. Den store fordelen av resonans teori er at, selv om basert på strenge matematisk analyse, resonans teori kan brukes med hell viste liten eller ingen matematikk. Resonans teori forklares nedenfor ved hjelp av nitrat ion som eksempel.
Ifølge for å resonans teori, strukturen av nitrat ion er ikke 1 eller 2 eller 3, men gjennomsnittet av alle tre av dem, avhengig av stabilitet., Lewis diagrammer 1, 2, og 3 kalles resonans former, resonans strukturer, eller resonans bidragsytere av nitrat ion. Strukturen av nitrat ion sies å være en resonans hybrid eller, rett og slett, som er en hybrid av resonans former 1, 2, og 3. Når det er nødvendig for å vise strukturen av nitrat ion, resonans former 1, 2, og 3 er trukket, forbundet med en tohodet piler.,
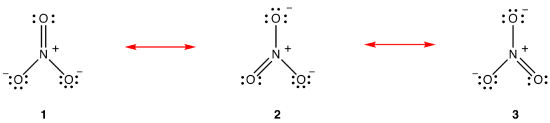
De tre resonans former av nitrat ion, 1, 2, og 3, er identiske, slik at de har den samme stabilitet og, derfor, bidrar like mye til hybrid., Siden den eksakte grad hver resonans form av nitrat-ion-bidrar til å hybrid er kjent, bond for hver nitrogen-oksygen bond samt det formelle ansvaret på hver oksygen atom i hybrid lett kan bestemmes:
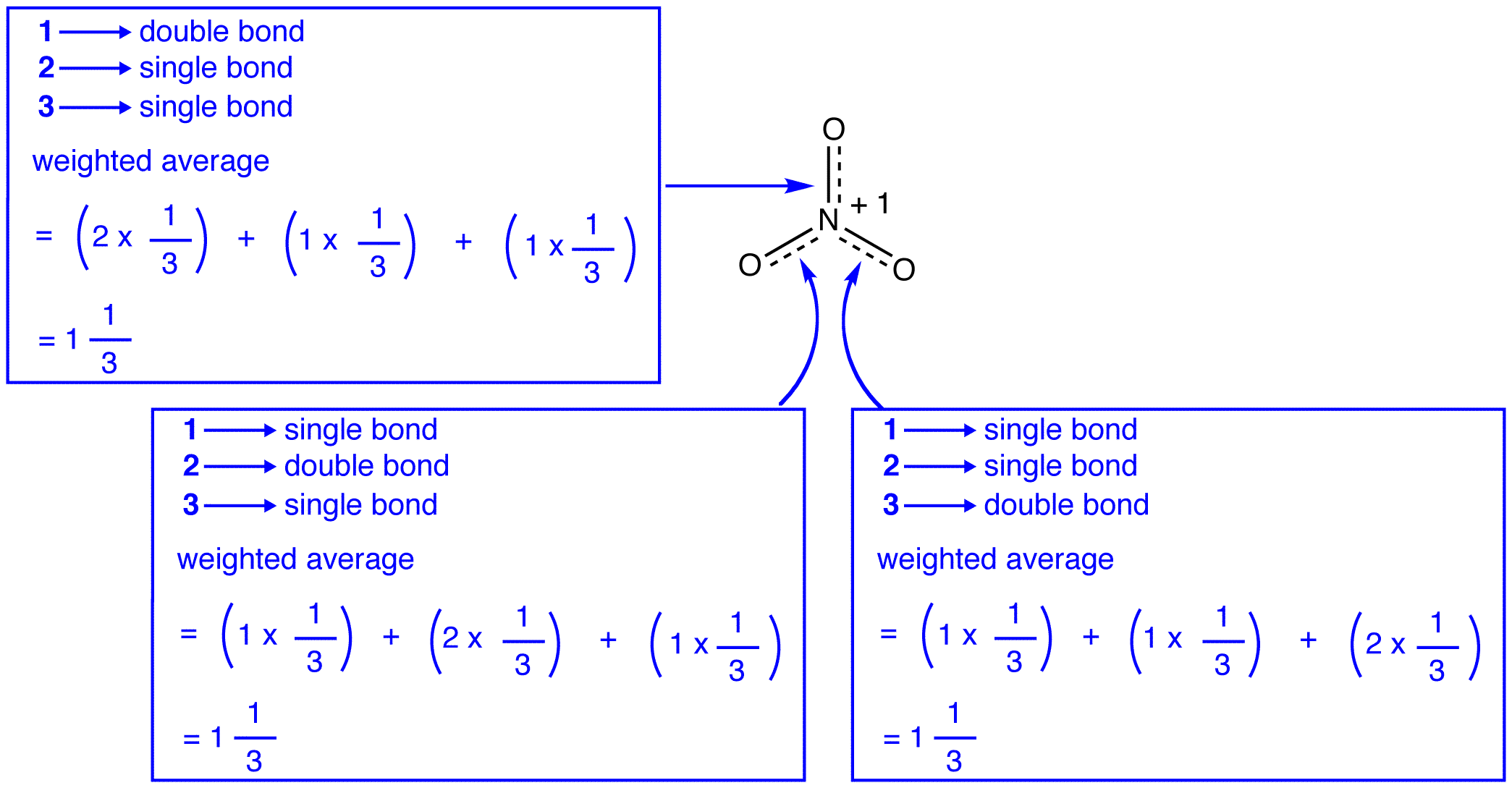
Ifølge for å resonans teori, hver bond i nitrat ion er en og en tredjedel av en obligasjon, som er konsistent med den observasjon at de tre obligasjonslån i det nitrat ion har samme bånd lengde og samme bond energi.,
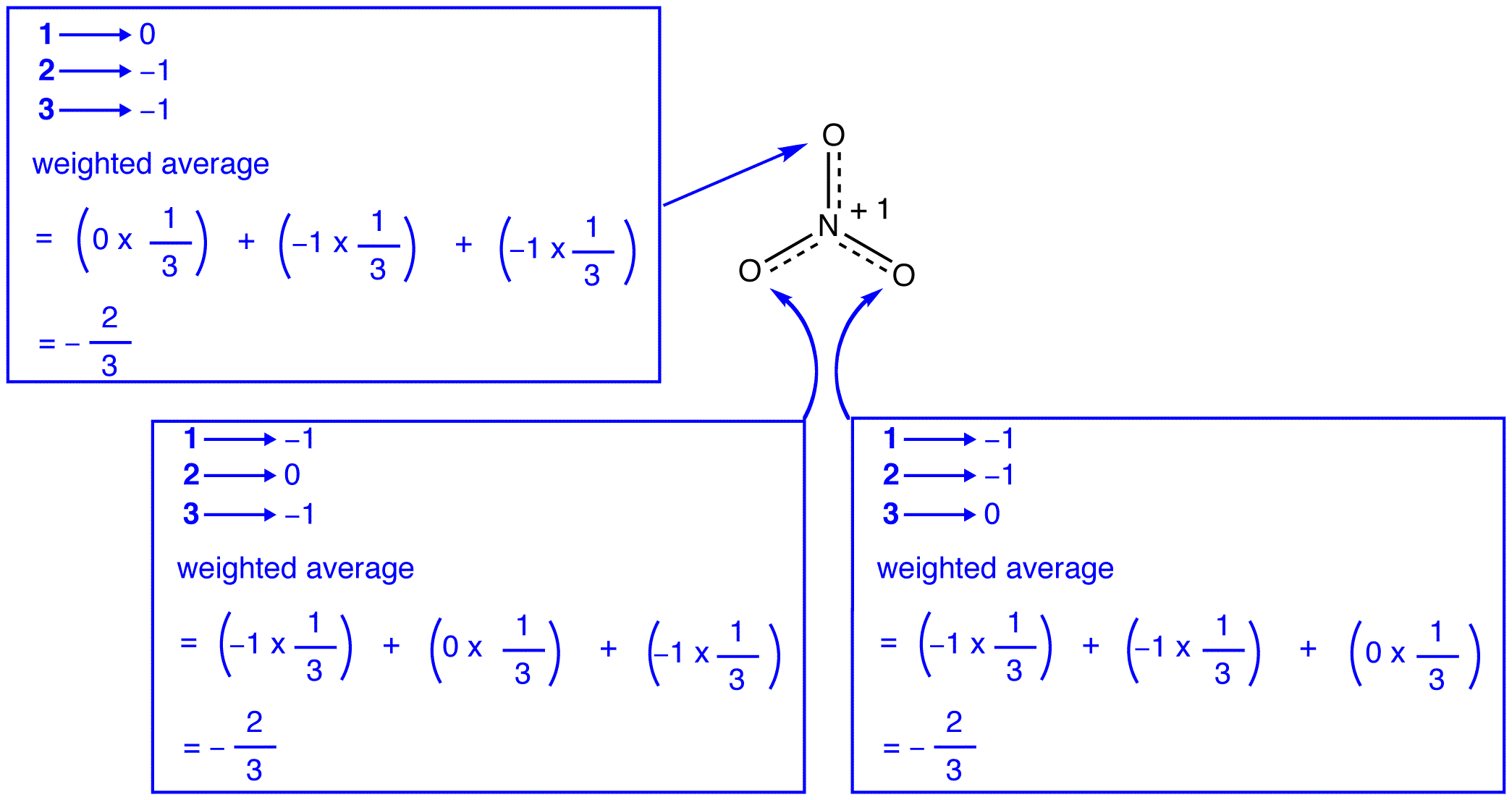
Ifølge for å resonans teori, hver oksygen atom i nitrat ion har en formell lade -2/3, som, sammen med det faktum at de tre nitrogen-oksygen obligasjoner er identiske, er konsistent med den observasjon at de tre oksygen atomer i nitrat ion er umulig å skille. I hvert resonans form av nitrat-ion, det er to \(\pi\) elektroner, og de er bare deles av to atomer. Et elektron bare deles av to atomer er sagt å være lokalisert., Dermed, de to \(\pi\) elektroner i hver resonans form av nitrat ion er lokalisert. Den nitrat ion, som representeres av hybrid, har to \(\pi\) elektroner:
- # elektroner i en \(\pi\) obligasjonslån = 2
- # elektroner i en tredjedel av a \(\pi\) obligasjonslån = 2/3
- # elektroner i tre av dem = 3 x (2/3) = 2
De to \(\pi\) elektroner i nitrat ion er delt av en total av fire atomer, et nitrogen atom og tre oksygen atomer. Et elektron som deles av mer enn to atomer er sagt å være delocalized. Dermed, de to \(\pi\) elektroner i nitrat ion er delocalized., Delocalization av \(\pi\) elektroner i nitrat ion krever at de fire atomene være på samme plan, slik at lateral overlapping av p-orbitals på dem.,

Hvis energien av nitrat ion ble veid gjennomsnitt av energier av sine tre resonans former, akkurat som strukturen av nitrat ion er et vektet gjennomsnitt av strukturer av sine tre resonans former, det skal være lik energi av en av de tre identiske resonans former:

Hvis energien av hybrid var lik som for en resonans form, gitt at alle kjemiske enheter (elementærpartikler, atomer, molekyler, etc.,) naturlig tendens til å være på lavest mulig energi tilstand, ville det ikke være noen fordel for nitrat ion å eksistere som hybrid; det kan bare eksistere som en resonans form. Siden nitrat ion eksisterer som hybrid, ikke som en resonans form, kan det utledes at energien av hybrid er lavere enn for noen av resonans former.

Ifølge for å resonans teori da, energien av et molekyl er lavere enn på den lavest energi resonans form., Siden nitrat ion har lavere energi, og derfor er mer stabil enn noen av sine resonans former, nitrat ion sies å være resonans stabilisert seg.
Vanlige Misoppfatninger
Det er to misforståelser om resonans teori blant begynnelsen studenter, trolig på grunn bokstavelig tolkning av ordet resonans. De er beskrevet nedenfor, med nitrat ion som eksempel.
Misforståelse 1: nitrat ion eksisterer som resonans skjema 1 for et øyeblikk, og deretter endrer enten å resonans form 2 eller resonans skjema 3, som interconvert, eller gå tilbake til 1.,

strukturen av nitrat ion er ikke 1 eller 2 eller 3, men hybrid og ikke endres med tiden, med mindre gjennomgår en reaksjon.
Misforståelse 2: I en prøve av nitrat ioner, i et gitt øyeblikk, en tredjedel av ioner som finnes resonans skjema 1, annet en tredjedel som resonans skjema 2, og den resterende tredjedelen som resonans skjema 3.

I en prøve av nitrat ioner, i et gitt øyeblikk, alle ioner har den samme struktur, som er en hybrid.,
Muldyr og Neshorn
klassisk analogi brukes til å avklare disse to misforståelser er muldyr (Morrison, R. T.; Boyd, R.N. Organisk Kjemi, fifth edition, Allyn and Bacon: Boston, 1987, pg. 373). Biologisk, et muldyr er en hybrid av en hest og et esel. Dette betyr ikke at et muldyr ligner en hest for en stund, og endringer for å ligne et esel. Utseendet av et muldyr er en kombinasjon av at en hest og et esel og ikke endrer seg med tiden. Heller betyr det at, i en flokk, noen muldyr ligner på en hest, og den andre et esel., I en flokk, alle muldyr har samme utseende, som er en kombinasjon av en hest og et esel. Svakheten med denne analogien er at hester og esler eksisterer, mens resonans former er strengt hypotetisk. En bedre analogi, sitert i Morrison og Boyd, er neshorn. Ved å se et neshorn, man kan beskrive det som en hybrid av en drage og en enhjørning, to skapninger som ikke eksisterer.