Eccezione 2: Ottetti incompleti
La seconda eccezione alla regola dell’ottetto è quando ci sono troppo pochi elettroni di valenza che si traduce in un ottetto incompleto. Ci sono ancora più occasioni in cui la regola dell’ottetto non fornisce la rappresentazione più corretta di una molecola o di uno ion. Questo è anche il caso degli ottetti incompleti. Le specie con ottetti incompleti sono piuttosto rare e generalmente si trovano solo in alcuni composti di berillio, alluminio e boro, inclusi gli idruri di boro., Diamo un’occhiata a uno di questi idruri, \(BH_3\) (Borano).
Se uno era di fare una struttura di Lewis per \(BH_3\) seguendo le strategie di base per il disegno di strutture di Lewis, uno probabilmente venire con questa struttura (Figura 3):
Il problema con questa struttura è che il boro ha un ottetto incompleto; ha solo sei elettroni attorno ad esso., Gli atomi di idrogeno possono naturalmente avere solo 2 elettroni nel loro guscio più esterno (la loro versione di un ottetto), e come tale non ci sono elettroni di ricambio per formare un doppio legame con il boro. Si potrebbe supporre che il fallimento di questa struttura per formare ottetti completi deve significare che questo legame dovrebbe essere ionico invece di covalente., Tuttavia, il boro ha un’elettronegatività molto simile all’idrogeno, il che significa che probabilmente c’è molto poco carattere ionico nei legami idrogeno-boro, e come tale questa struttura di Lewis, sebbene non soddisfi la regola dell’ottetto, è probabilmente la migliore struttura possibile per descrivere BH3 con la teoria di Lewis. Una delle cose che possono spiegare l’ottetto incompleto di BH3 è che è comunemente una specie transitoria, formata temporaneamente in reazioni che coinvolgono più passaggi.
Diamo un’occhiata a un’altra situazione di ottetto incompleta che si occupa di boro, BF3 (trifluorina di boro)., Come con BH3, il disegno iniziale di una struttura di Lewis di BF3 formerà una struttura in cui il boro ha solo sei elettroni attorno ad esso (Figura 4).
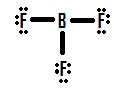
Se si guarda la Figura 4, si può vedere che l’atomo di fluoro in possesso di extra lone pairs che possono utilizzare per apportare ulteriori legami con boro, e si potrebbe pensare che tutto quello che dovete fare è fare un lone pair in un legame e la struttura dovrà essere corretto., Se ci aggiungi un doppio legame tra boro e uno di fluoro, si ottiene la seguente Struttura di Lewis (Figura 5):
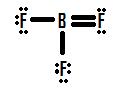
Ogni fluoro ha otto elettroni, e l’atomo di boro ha otto, come pure! Ogni atomo ha un ottetto perfetto, giusto? Non cosi ‘ in fretta. Dobbiamo esaminare le accuse formali di questa struttura. Il fluoro che condivide un doppio legame con il boro ha sei elettroni attorno ad esso (quattro dalle sue due coppie di elettroni solitari e uno ciascuno dai suoi due legami con il boro)., Questo è un elettrone in meno del numero di elettroni di valenza che avrebbe naturalmente (il gruppo sette elementi ha sette elettroni di valenza), quindi ha una carica formale di +1. Le due flourine che condividono singoli legami con il boro hanno sette elettroni intorno a loro (sei dalle loro tre coppie solitarie e uno dai loro singoli legami con il boro). Questa è la stessa quantità del numero di elettroni di valenza che avrebbero da soli, quindi entrambi hanno una carica formale di zero. Infine, il boro ha quattro elettroni attorno ad esso (uno da ciascuno dei suoi quattro legami condivisi con il fluoro)., Questo è un elettrone in più del numero di elettroni di valenza che il boro avrebbe da solo, e come tale il boro ha una carica formale di -1.
Questa struttura è supportata dal fatto che la lunghezza del legame determinata sperimentalmente dei legami boro-fluoro in BF3 è inferiore a quella tipica di un singolo legame (vedi Ordine di legame e lunghezze)., Tuttavia, questa struttura contraddice una delle principali regole delle cariche formali: si suppone che le cariche formali negative si trovino sugli atomi più elettronegativi in un legame, ma nella struttura raffigurata in Figura 5, una carica formale positiva si trova sul fluoro, che non solo è l’elemento più elettronegativo nella struttura, ma l’elemento più elettronegativo nell’intera tavola periodica (\(\chi=4.0\)). Il boro d’altra parte, con l’elettronegatività molto più bassa di 2.0, ha la carica formale negativa in questa struttura., Questo disaccordo formale di carica-elettronegatività rende impossibile questa struttura a doppio legame.
Tuttavia la grande differenza di elettronegatività qui, al contrario di BH3, significa legami polari significativi tra boro e fluoro, il che significa che c’è un alto carattere ionico in questa molecola. Questo suggerisce la possibilità di un semi-ionico struttura, come visto in Figura 6:

Nessuna di queste tre strutture è “corretta” struttura in questo caso., La struttura più” corretta ” è probabilmente una risonanza di tutte e tre le strutture: quella con l’ottetto incompleto (Figura 4), quella con il doppio legame (Figura 5) e quella con il legame ionico (Figura 6). La struttura più contributiva è probabilmente la struttura incompleta dell’ottetto (a causa del fatto che la figura 5 è fondamentalmente impossibile e la figura 6 non corrisponde al comportamento e alle proprietà di BF3). Come si può vedere anche quando esistono altre possibilità, ottetti incompleti possono meglio ritrarre una struttura molecolare.,
Come nota a margine, è importante notare che BF3 si lega frequentemente con uno ion F per formare BF4 – piuttosto che rimanere come BF3. Questa struttura completa l’ottetto del boro ed è più comune in natura. Ciò esemplifica il fatto che gli ottetti incompleti sono rari e altre configurazioni sono in genere più favorevoli, incluso il legame con ioni aggiuntivi come nel caso di BF3 .
Esempio: \(BF_3\)
Disegna la struttura di Lewis per il trifluoruro di boro (BF3).
Soluzione
1. Aggiungere elettroni (3*7) + 3 = 24
2., Disegnare connessioni:
3. Aggiungi ottetti agli atomi esterni:
4. Aggiungi elettroni extra (24-24=0) all’atomo centrale:
5. L’elettrone centrale ha l’ottetto?
- N. Ha 6 elettroni
- Aggiungi un legame multiplo (doppio legame) per vedere se l’atomo centrale può ottenere un ottetto:
6. Il boro centrale ora ha un ottetto (ci sarebbero tre strutture di Lewis di risonanza)
Tuttavia…,
- In questa struttura con un doppio legame l’atomo di fluoro condivide elettroni extra con il boro.
- Il fluoro avrebbe una carica parziale ‘ + ‘e il boro una carica parziale’ -‘, questo è incoerente con l’elettronegatività del fluoro e del boro.
- Quindi, la struttura di BF3, con legami singoli e 6 elettroni di valenza attorno al boro centrale è la struttura più probabile
- BF3 reagisce fortemente con composti che hanno una coppia di elettroni non condivisa che può essere utilizzata per formare un legame con il boro: