Obiettivi di Apprendimento
- Definire corrosione
- Elenco di alcuni dei metodi utilizzati per prevenire o rallentare la corrosione
la Corrosione è di solito definito come il degrado dei metalli a causa di un processo elettrochimico. La formazione di ruggine sul ferro, l’appannamento sull’argento e la patina blu-verde che si sviluppa sul rame sono tutti esempi di corrosione., Il costo totale della corrosione negli Stati Uniti è significativo, con stime superiori a mezzo trilione di dollari all’anno.
Forse l’esempio più familiare di corrosione è la formazione di ruggine sul ferro. Il ferro arrugginisce quando è esposto all’ossigeno e all’acqua. I passaggi principali nella ruggine del ferro sembrano coinvolgere quanto segue (Figura 2). Una volta esposto all’atmosfera, il ferro si ossida rapidamente.
Gli elettroni riducono l’ossigeno nell’aria in soluzioni acide.
Ciò che noi chiamiamo la ruggine è idrato di ferro(III) ossido che si forma quando il ferro(II) gli ioni reagiscono ulteriormente con l’ossigeno.,
Il numero di molecole di acqua è variabile, quindi è rappresentato da x. A differenza il colore della patina di rame, la formazione di ruggine non creare uno strato protettivo e quindi la corrosione del ferro continua come la ruggine fiocchi off ed espone fresco di ferro per l’atmosfera.
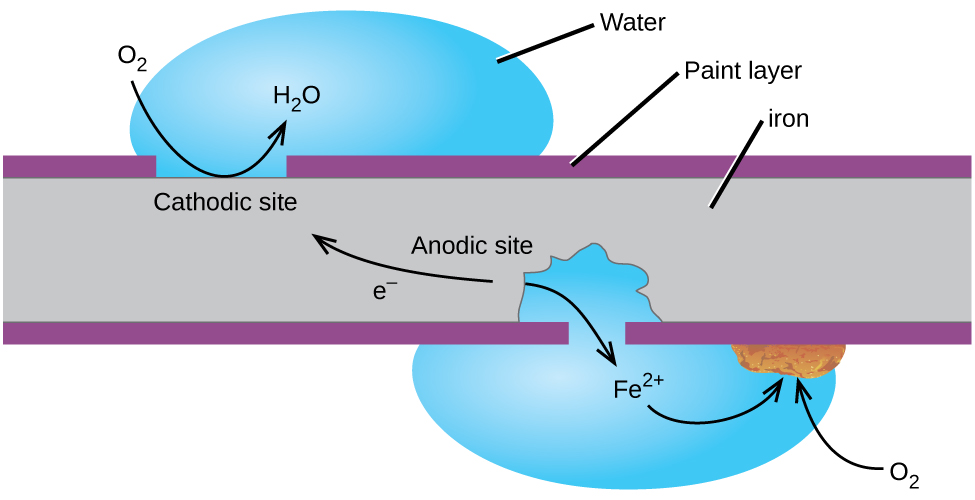
Un modo per mantenere il ferro dalla corrosione è quello di tenerlo dipinto. Lo strato di vernice impedisce all’acqua e all’ossigeno necessari per la formazione di ruggine di entrare in contatto con il ferro. Finché la vernice rimane intatta, il ferro è protetto dalla corrosione.,
Altre strategie includono la lega del ferro con altri metalli. Ad esempio, l’acciaio inossidabile è per lo più ferro con un po ‘ di cromo. Il cromo tende a raccogliere vicino alla superficie, dove forma uno strato di ossido che protegge il ferro.
Il ferro zincato o zincato utilizza una strategia diversa. Lo zinco è più facilmente ossidato del ferro perché lo zinco ha un potenziale di riduzione inferiore. Poiché lo zinco ha un potenziale di riduzione inferiore, è un metallo più attivo. Pertanto, anche se il rivestimento di zinco è graffiato, lo zinco si ossida ancora prima del ferro., Ciò suggerisce che questo approccio dovrebbe funzionare con altri metalli attivi.
Un altro modo importante per proteggere il metallo è quello di renderlo il catodo in una cella galvanica. Questa è la protezione catodica e può essere utilizzata per metalli diversi dal ferro. Ad esempio, l’arrugginimento di serbatoi e tubi di ferro sotterranei può essere prevenuto o notevolmente ridotto collegandoli a un metallo più attivo come zinco o magnesio (Figura 3). Questo è anche usato per proteggere le parti metalliche negli scaldacqua., I metalli più attivi (potenziale di riduzione inferiore) sono chiamati anodi sacrificali perché man mano che si esauriscono si corrodono (si ossidano) all’anodo. Il metallo protetto funge da catodo e quindi non si ossida (corrode). Quando gli anodi sono adeguatamente monitorati e periodicamente sostituiti, la durata utile del serbatoio di stoccaggio del ferro può essere notevolmente estesa.
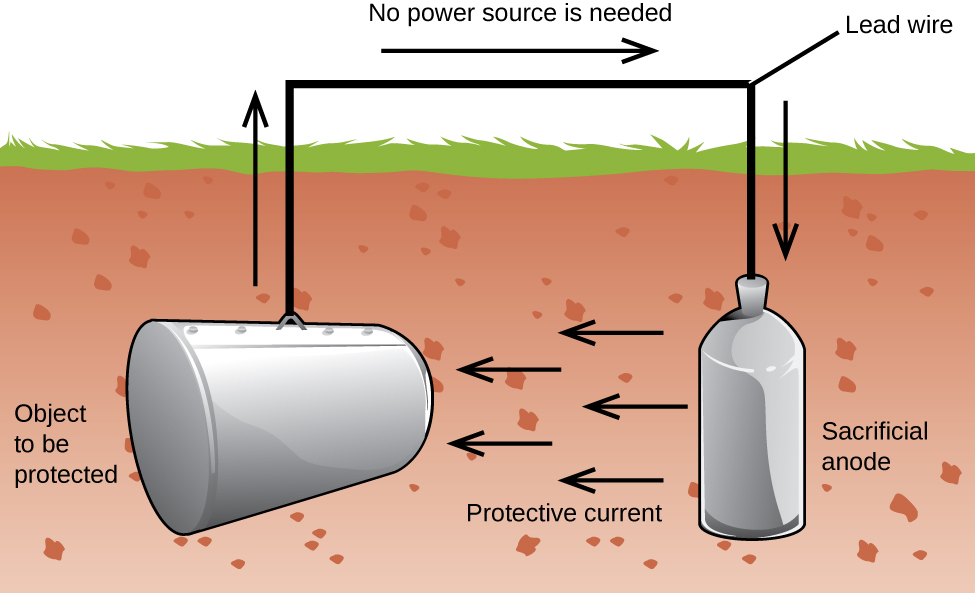
La corrosione è la degradazione di un metallo causata da un processo elettrochimico. Ogni anno si spendono ingenti somme di denaro per riparare o prevenire gli effetti della corrosione. Alcuni metalli, come alluminio e rame, producono uno strato protettivo quando si corrodono nell’aria., Lo strato sottile che si forma sulla superficie del metallo impedisce all’ossigeno di entrare in contatto con più atomi di metallo e quindi “protegge” il metallo rimanente da ulteriore corrosione. Il ferro si corrode (forma ruggine) quando esposto all’acqua e all’ossigeno. La ruggine che si forma sul metallo di ferro si sfalda, esponendo il metallo fresco, che si corrode anche. Un modo per prevenire, o rallentare, la corrosione è rivestendo il metallo. Il rivestimento impedisce all’acqua e all’ossigeno di contattare il metallo. Vernice o altri rivestimenti rallenterà la corrosione, ma non sono efficaci una volta graffiato., Il ferro zincato o zincato sfrutta il fatto che lo zinco ha maggiori probabilità di ossidarsi rispetto al ferro. Finché il rivestimento rimane, anche se graffiato, lo zinco si ossida prima del ferro. Un altro metodo per proteggere i metalli è la protezione catodica. In questo metodo, un metallo facilmente ossidato e poco costoso, spesso zinco o magnesio (l’anodo sacrificale), è collegato elettricamente al metallo che deve essere protetto. Il metallo più attivo è l’anodo sacrificale, ed è l’anodo in una cella galvanica. Il metallo “protetto” è il catodo e rimane non ossidato., Un vantaggio della protezione catodica è che l’anodo sacrificale può essere monitorato e sostituito se necessario.,
Glossario
protezione catodica metodo di protezione del metallo utilizzando un anodo sacrificale e in modo efficace rendendo il metallo che ha bisogno di protezione catodica, impedendo l’ossidazione corrosione degrado di metallo attraverso un processo elettrochimico di ferro zincato metodo per proteggere il ferro coprendolo con lo zinco, che si ossida prima che il ferro; ferro zincato anodo sacrificale più attivo, poco costoso metallo utilizzato come anodo di protezione catodica; spesso in magnesio o zinco
Soluzioni
le Risposte, alla Chimica, alla Fine del Capitolo Esercizi
2., Mg e Zn
4. Entrambi gli esempi riguardano la protezione catodica. L’anodo (sacrificale) è il metallo che corrode (ossida o reagisce). Nel caso di ferro (-0,447 V) e zinco (-0,7618 V), lo zinco ha un potenziale di riduzione standard più negativo e quindi funge da anodo. Nel caso di ferro e rame (0,34 V), il ferro ha il potenziale di riduzione standard più piccolo e quindi corrode (funge da anodo).
6., Mentre il potenziale di riduzione del litio lo renderebbe in grado di proteggere gli altri metalli, questo alto potenziale è anche indicativo di quanto sia reattivo il litio; avrebbe una reazione spontanea con la maggior parte delle sostanze. Ciò significa che il litio reagirebbe rapidamente con altre sostanze, anche quelle che non ossidano il metallo che sta tentando di proteggere. Reattività come questa significa che l’anodo sacrificale si esaurirebbe rapidamente e dovrebbe essere sostituito frequentemente. (Motivo aggiuntivo opzionale: pericolo di incendio in presenza di acqua.)