La Brønsted-Lowry Teoria degli Acidi e delle Basi
Brønsted-Lowry teoria degli acidi e delle basi ha preso la definizione di Arrhenius un ulteriore passo in avanti, come una sostanza, non è più necessario essere composto di idrogeno (H+) o idrossido (OH-) ioni per essere classificato come un acido o una base. Per exmapl, si consideri la seguente equazione chimica:
\
- Un acido di Brønsted-Lowry è un donatore di protoni (ioni idrogeno).
- Una base di Brønsted-Lowry è un accettore di protoni (ioni idrogeno).,
In questa teoria, un acido è una sostanza che può rilasciare un protone (come nella teoria di Arrhenius) e una base è una sostanza che può accettare un protone., Una base di sale, come Na+, F-, genera ioni OH – in acqua prendendo protoni dall’acqua stessa (per rendere HF):
\
- di dissociazione Acida
\
- Acido Costante di Ionizzazione:
\}{}\]
- Base di dissociazione:
\
- Base Costante di Ionizzazione
\}{}\]
La determinazione di una sostanza come Brønsted-Lowery di acido o di base può essere fatto osservando la reazione. Nel caso dell’HOH è una base nel primo caso e un acido nel secondo caso.,
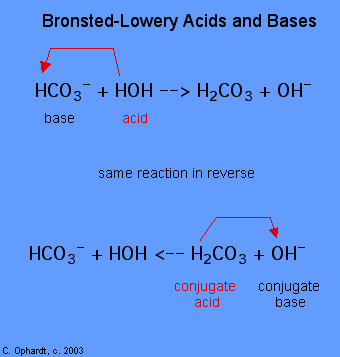
Per determinare se una sostanza è un acido o una base, contare gli idrogeni su ciascuna sostanza prima e dopo la reazione. Se il numero di idrogeni è diminuito quella sostanza è l’acido (dona ioni idrogeno). Se il numero di idrogeni è aumentato quella sostanza è la base (accetta ioni idrogeno). Queste definizioni sono normalmente applicate ai reagenti sulla sinistra. Se la reazione viene visualizzata al contrario, è possibile identificare un nuovo acido e una nuova base., Le sostanze sul lato destro dell’equazione sono chiamate acido coniugato e base coniugata rispetto a quelle a sinistra. Si noti inoltre che l’acido originale si trasforma nella base coniugata dopo che la reazione è finita.
Nota
Gli acidi sono donatori di protoni e le basi sono accettori di protoni
Affinché una reazione sia in equilibrio deve avvenire un trasferimento di elettroni. L’acido darà via un elettrone e la base riceverà l’elettrone. Acidi e basi che lavorano insieme in questo modo sono chiamati una coppia coniugata composta da acidi coniugati e basi coniugate.,
\
A sta per un composto acido e Z sta per un composto di base
- A Dona H per formare HZ+.
- Z Accetta H da cui forme HZ+
- Un – diventa la base coniugata di HA e nella reazione inversa si accetta un H da HZ a ricreare HA per rimanere in equilibrio
- HZ+ diventa un acido coniugato di Z e la reazione inversa si dona a H a A – ricreare Z per rimanere in equilibrio