Il modello di Bohr del 1913 dell’atomo di idrogeno fu sostituito dal modello meccanico a onde di SchrodingerʹS nel 1926. Tuttavia, il modello di Bohr è ancora oggi proficuamente insegnato a causa della sua semplicità concettuale e matematica, e perché ha introdotto una serie di idee chiave della meccanica quantistica come il numero quantico, la quantizzazione delle proprietà osservabili, il salto quantico e lo stato stazionario.,
Bohr calcolò la molteplicità di energie elettroniche consentite bilanciando le forze meccaniche (centripeto ed elettrone‐nucleo) su un elettrone che eseguiva un’orbita circolare di raggio R attorno al nucleo, e quindi quantizzando arbitrariamente il suo momento angolare. Infine con fiat dichiarò che l’elettrone era in uno stato stazionario non radiante perché una carica orbitante (accelerante) irradia energia e collasserà nel nucleo di carica opposta.,
Nel 1924 de Broglie postulò la dualità onda‐particella per l’elettrone e altre particelle massicce, fornendo così l’opportunità di rimuovere parte dell’arbitrarietà dal modello di Bohr. Ad esempio, un elettrone che possiede proprietà d’onda è soggetto a interferenze costruttive e distruttive. Come verrà mostrato, questo porta naturalmente alla quantizzazione del momento dell’elettrone e dell’energia cinetica, e di conseguenza una varietà di stati energetici consentiti per l’elettrone rispetto al nucleo., Il modello de Broglie-Bohr dell’atomo di idrogeno qui presentato tratta l’elettrone come una particella su un anello con proprietà ondulatorie.
\
l’ipotesi di de Broglie che la materia abbia proprietà ondulatorie.
\
La conseguenza dell’ipotesi di de Brogliè; un numero integrale di lunghezze d’onda deve rientrare nella circonferenza dell’orbita. Questo introduce il numero quantico che può avere valori 1,2,3,… Lo stato di elettroni n = 4 è mostrato di seguito.,
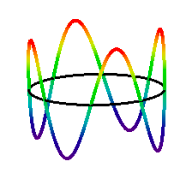
\
La sostituzione della prima equazione nella seconda equazione rivela che la quantità di moto è quantizzata.
\
Se la quantità di moto è quantizzata, lo è anche l’energia cinetica.
\
Che significa che l’energia totale è quantizzata. Il secondo termine è l’energia potenziale elettrostatica elettrone‐protone.
L’interpretazione meccanica quantistica di queste orbite ʺBohr is è che sono stati stazionari. Nonostante il fatto che usiamo l’espressione energia cinetica, che implica il movimento degli elettroni, non c’è movimento., L’elettrone occupa l’orbita come un’onda di particelle, non orbita attorno al nucleo. Se fosse in orbita in senso classico, irraderebbe energia e collasserebbe rapidamente nel nucleo. Chiaramente la stabilità della materia richiede la versione meccanica quantistica dell’energia cinetica.
L’energia dello stato fondamentale e il raggio dell’orbita dell’elettrone nell’atomo di idrogeno si trovano tracciando l’energia in funzione del raggio orbitale. Lo stato fondamentale è il minimo nella curva di energia totale., Naturalmente il calcolo può essere utilizzato per ottenere le stesse informazioni riducendo al minimo l’energia rispetto al raggio dell’orbita. Tuttavia, il metodo grafico ha la virtù di illuminare la questione della stabilità atomica.
Costanti fondamentali: carica dell’elettrone, massa dell’elettrone, costante di Planck, permitività del vuoto.
Numero quantico e fatto di conversione tra metri e picometri e joule e attojoule.
\
\
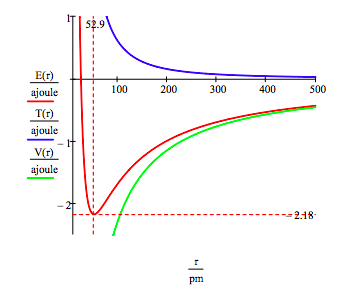
Questa figura mostra che la stabilità atomica comporta un equilibrio tra energia potenziale e cinetica., L’elettrone è attratto verso il nucleo dall’interazione di energia potenziale attraente (~ -1/R), ma viene impedito di collassare nel nucleo dall’energia cinetica estremamente grande (~1/R2) associata a piccole orbite.
Come mostrato di seguito, l’approccio grafico può essere utilizzato anche per trovare gli stati eccitati elettronici.
\
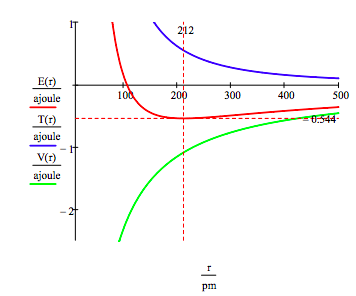
Come accennato in precedenza, la molteplicità di energie di elettroni consentite può essere ottenuta anche riducendo al minimo l’energia rispetto al raggio dell’orbita. Questa procedura produce,