Introduzione
Gli elettroni non hanno una posizione fissa in atomi, composti e molecole (vedi immagine sotto) ma hanno probabilità di essere trovati in determinati spazi (orbitali). Le forme di risonanza illustrano aree di probabilità più elevate (densità di elettroni). Questo è come tenere il cappello nella mano destra o nella sinistra. Il termine Risonanza si applica quando ci sono due o più possibilità disponibili., I chimici usano i diagrammi di Lewis per rappresentare la struttura e il legame di entità covalenti, come molecole e ioni poliatomici, d’ora in poi, molecole. Il diagramma di Lewis di molte molecole, tuttavia, non è coerente con le proprietà osservate della molecola.
Esempio \(\PageIndex{1}\): Nitrate nitrato
Lo nitrate nitrato, secondo il suo diagramma di Lewis, ha due tipi di legami azoto-ossigeno, un doppio legame e due singoli legami, suggerendo che un legame azoto-ossigeno nello ion nitrato è più corto e più forte di ciascuno degli altri due., Inoltre, la struttura di Lewis implica, rispetto alla carica formale, che ci sono due tipi di atomi di ossigeno nello ion nitrato, uno formalmente neutro e ciascuno degli altri due con una carica formale di -1. Sperimentalmente, tuttavia, i tre legami azoto-ossigeno nello nitrate nitrato hanno la stessa lunghezza di legame e la stessa energia di legame, e i tre atomi di ossigeno sono indistinguibili. Il diagramma di Lewis non riesce a spiegare la struttura e il legame dello nitrate nitrato in modo soddisfacente.
È possibile disegnare due diagrammi di Lewis aggiuntivi per lo nitrate nitrato.,
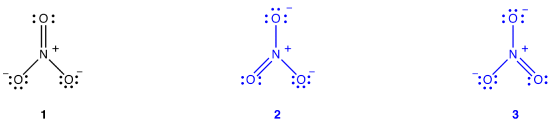
Tuttavia, nessuno di essi è coerente con le proprietà osservate dello nitrate nitrato e, quindi, non descrive correttamente lo ion nitrato.
Esempio \(\PageIndex{2}\): Benzene
Il benzene, secondo il suo diagramma di Lewis, ha due tipi di legami carbonio-carbonio, tre doppi legami e tre singoli legami, suggerendo che ciascuno dei tre legami carbonio-carbonio nel benzene è più corto e più forte di ciascuno degli altri tre. Sperimentalmente, tuttavia, i sei legami carbonio-carbonio nel benzene hanno la stessa lunghezza di legame e la stessa energia di legame., Il diagramma di Lewis non riesce a spiegare in modo soddisfacente la struttura e il legame del benzene.
Un attributo di molecole di cui il diagramma di Lewis classico non è coerente con le proprietà osservate è che altri diagrammi di Lewis validi possono essere generati per loro. Un diagramma di Lewis aggiuntivo può essere disegnato per il benzene.

Tuttavia, nessuno di essi è coerente con le proprietà osservate del benzene e, pertanto, non descrive correttamente il benzene.,
La teoria della risonanza è un tentativo di spiegare la struttura di una specie, come lo nitrate nitrato o il benzene, nessun diagramma di Lewis è coerente con le proprietà osservate della specie. Il principale vantaggio della teoria della risonanza è che, sebbene basata su una rigorosa analisi matematica, la teoria della risonanza può essere applicata con successo invocando poca o nessuna matematica. La teoria della risonanza è spiegata di seguito usando lo nitrate nitrato come esempio.
Secondo la teoria della risonanza, la struttura dello nitrate nitrato non è 1 né 2 né 3 ma la media di tutti e tre, ponderata dalla stabilità., I diagrammi di Lewis 1, 2 e 3 sono chiamati forme di risonanza, strutture di risonanza o contributori di risonanza dello nitrate nitrato. Si dice che la struttura dello nitrate nitrato sia un ibrido di risonanza o, semplicemente, ibrido delle forme di risonanza 1, 2 e 3. Ogni volta che è necessario mostrare la struttura dello nitrate nitrato, le forme di risonanza 1, 2 e 3 sono disegnate, collegate da frecce a doppia testa.,
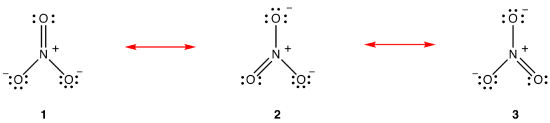
Le tre forme di risonanza dello nitrate nitrato, 1, 2 e 3, sono identiche, quindi hanno la stessa stabilità e, quindi, contribuiscono ugualmente all’ibrido., Dato l’esatta misura in cui ogni forma di risonanza dello ione nitrato contribuisce per l’ibrido è noto, il legame di ogni azoto-ossigeno bond, così come la carica formale su ogni atomo di ossigeno in hybrid può essere facilmente determinato:
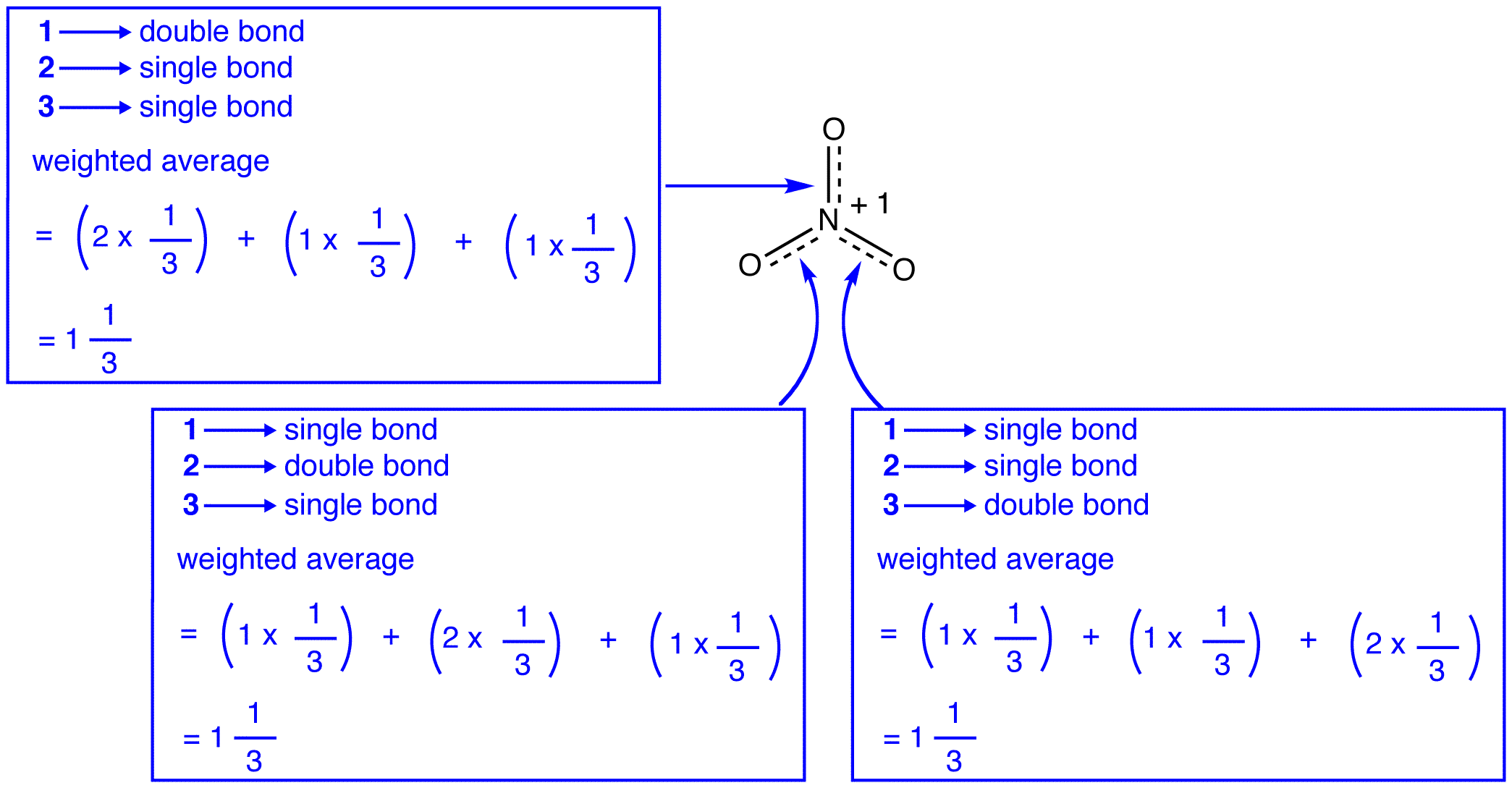
Secondo la teoria di risonanza, ogni legame in ione nitrato è uno, e un terzo di un bond, il che è coerente con l’osservazione che il tre bond in ione nitrato hanno la stessa lunghezza di legame e la stessa energia di legame.,
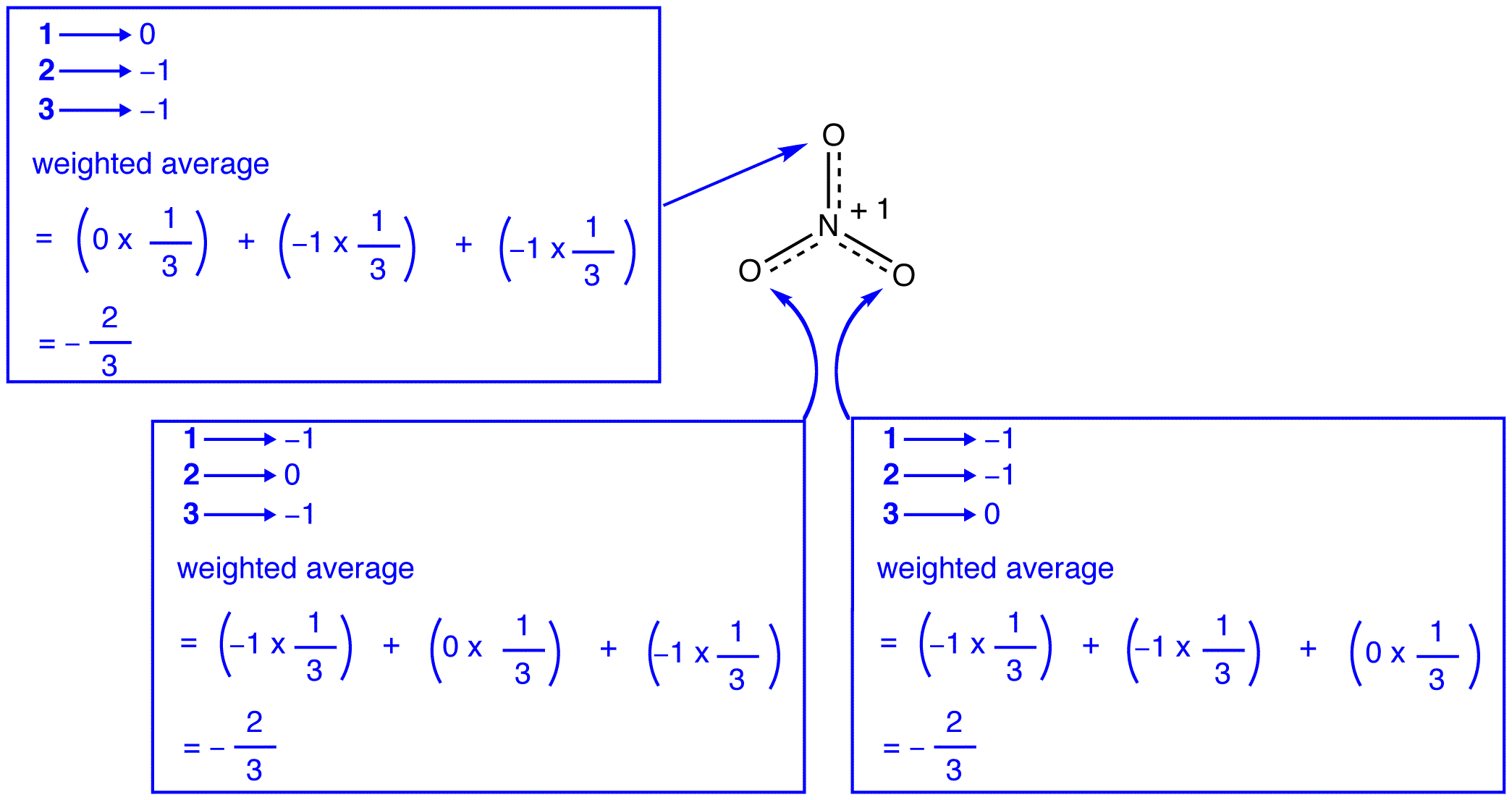
Secondo la teoria di risonanza, ogni atomo di ossigeno in ione nitrato è una carica formale di -2/3, che, in combinazione con il fatto che le tre azoto-ossigeno obbligazioni sono identici, è coerente con l’osservazione che i tre atomi di ossigeno in ione nitrato sono indistinguibili. In ogni forma di risonanza dello nitrate nitrato, ci sono due elettroni \(\pi\) e sono condivisi solo da due atomi. Si dice che un elettrone condiviso solo da due atomi sia localizzato., Pertanto, i due elettroni\ (\pi\) in ogni forma di risonanza dello ion nitrato sono localizzati. Lo ione nitrato, rappresentata dal ibrido, ha due \(\pi\) elettroni:
- # elettroni in un \(\pi\) bond = 2
- # elettroni in un terzo di un \(\pi\) bond = 2/3
- # elettroni in tre di loro = 3 x (2/3) = 2
I due \(\pi\) gli elettroni in ione nitrato sono condivisi da un totale di quattro atomi di un atomo di azoto e tre atomi di ossigeno. Si dice che un elettrone condiviso da più di due atomi sia delocalizzato. Pertanto, i due elettroni \ (\pi\) nello ion nitrato vengono delocalizzati., La delocalizzazione degli elettroni \(\pi\) nello nitrate nitrato richiede che i quattro atomi siano sullo stesso piano, consentendo la sovrapposizione laterale degli orbitali p su di essi.,

Se l’energia dello ione nitrato sono la media ponderata delle energie dei suoi tre forme risonanza, come la struttura dello ione nitrato è la media ponderata delle strutture delle tre forme risonanza, dovrebbe essere uguale all’energia di uno dei tre identiche forme risonanza:

Se l’energia dell’ibrido sono stati pari a quella di una risonanza forma, dato che tutte le entità chimiche (particelle elementari, atomi, molecole, etc.,) naturalmente tendono ad essere nel più basso stato energetico possibile, non ci sarebbe alcun vantaggio per lo nitrate nitrato di esistere come ibrido; potrebbe semplicemente esistere come una forma di risonanza. Poiché lo nitrate nitrato esiste come ibrido, non come forma di risonanza, si può dedurre che l’energia dell’ibrido è inferiore a quella di una qualsiasi delle forme di risonanza.

Secondo la teoria della risonanza, l’energia di una molecola è inferiore a quella della forma di risonanza a energia più bassa., Poiché lo nitrate nitrato ha un’energia inferiore e, quindi, è più stabile di qualsiasi forma di risonanza, si dice che lo resonance nitrato sia stabilizzato dalla risonanza.
Idee sbagliate comuni
Ci sono due idee sbagliate sulla teoria della risonanza tra gli studenti principianti, probabilmente a causa dell’interpretazione letterale della parola risonanza. Sono descritti di seguito, usando lo nitrate nitrato come esempio.
Equivoco 1: Lo nitrate nitrato esiste come forma di risonanza 1 per un momento e poi cambia in forma di risonanza 2 o in forma di risonanza 3, che interconverte o ritorna a 1.,

La struttura dello nitrate nitrato non è 1 né 2 né 3 ma l’ibrido e non cambia nel tempo a meno che non subisca una reazione.
Equivoco 2: In un campione di ioni nitrati, in un dato momento, un terzo degli ioni esiste come forma di risonanza 1, un altro terzo come forma di risonanza 2 e il restante terzo come forma di risonanza 3.

In un campione di ioni nitrati, in un dato momento, tutti gli ioni hanno la stessa struttura, che è l’ibrido.,
Muli e rinoceronti
L’analogia classica usata per chiarire questi due equivoci è il mulo (Morrison, RT; Boyd, RN Chimica organica, quinta edizione; Allyn e Bacon: Boston, 1987, pg. 373). Biologicamente, un mulo è un ibrido di un cavallo e un asino. Questo non significa che un mulo assomigli a un cavallo per un momento e poi cambia per assomigliare ad un asino. L’aspetto di un mulo è una combinazione di quello di un cavallo e quello di un asino e non cambia con il tempo. Né significa che, in una mandria, alcuni muli assomigliano a un cavallo e gli altri a un asino., In una mandria, tutti i muli hanno lo stesso aspetto, che è una combinazione di un cavallo e un asino. La debolezza di questa analogia è che esistono cavalli e asini, mentre le forme di risonanza sono strettamente ipotetiche. Un’analogia migliore, citata in Morrison e Boyd, è il rinoceronte. Vedendo un rinoceronte, si potrebbe descriverlo come l’ibrido di un drago e un unicorno, due creature che non esistono.