Bevezető
2-es Típusú diabetes mellitus (T2DM) az a jellemző, hogy az inzulin-rezisztencia, ami továbbra is viszonylag stabil a tanfolyam során a betegség, valamint egy fokozatos elvesztése β-sejt funkció nem megfelelő inzulin szekréció., Ennek a progresszív fejlődésnek köszönhetően a T2DM-ben szenvedő betegek többsége végül inzulint igényel a glikémiás kontroll eléréséhez és fenntartásához, egy lépésenkénti megközelítés alkalmazásával, kezdve a bazális inzulinnal orális szerekkel kombinálva. Ha a prandiális és posztprandiális glikémia nem megfelelően kontrollált, a következő lépésként az NPH (semleges protamin Hagedorn) vagy az előkevert inzulinkészítmények napi kétszeri inzulinkezelését kell előnyben részesíteni., Az 1-es típusú diabeteses betegekhez hasonlóan a basal-bolus inzulinterápiát olyan súlyos inzulinhiányban szenvedő T2DM-es betegeknél kell alkalmazni, akik napi kétszeri adagolás mellett nem képesek elérni és fenntartani a glikémiás célokat.1 ez Azonban inzulin kezelés egyértelműen kihasználatlan, valószínűleg azért, mert a vonakodása a betegek, mind az orvosok, összetettsége miatt a részt létrehozása, valamint a korlátozott információ áll rendelkezésre arról, hogy a megvalósíthatósági, különösen idős betegeknél, illetve annak hatékonyságát, a betegek korábban kezelt két inzulin adag.,2
a jelen vizsgálatban a bazális-bolus inzulinkezelés megvalósíthatóságát, hatékonyságát és biztonságosságát értékeltük hosszú távú, 2-es típusú cukorbetegségben szenvedő és gyenge vagy instabil glikémiás kontrollban szenvedő betegek esetében.
anyag és módszerek
ebben a prospektív, egyközpontú vizsgálatban 37 olyan beteget vontunk be, akiket 2006 októberétől 2007 októberéig basal-bolus inzulinkezelésre váltottak át, és az azt megelőző hat hónapban a beavatkozás ellenére instabil vagy gyenge glikémiás kontroll (glikált hemoglobin (HbA1c)≥8%) volt., A vizsgálati jegyzőkönyvet az intézményi etikai felülvizsgálati testületek jóváhagyták, és minden betegtől írásos beleegyezést kaptak.
a kezdeti kezelés során a szénhidrátokat a három fő étkezés során elosztották. A kezdeti glargin inzulin adagot az előző teljes napi adag 50% – ában, a kezdeti prandiális inzulint (aspart vagy lispro) pedig a teljes napi adag fennmaradó 50% – ában számították ki, amelyet egyenlően osztottak fel a három étkezés fedezésére., Azok a betegek, akik metformint szedtek a kezelés átállítása előtt, és nem rendelkeztek ellenjavallattal, folytatták a kezelést ugyanabban az adagban. A többi orális antidiabetikus gyógyszert leállították.
minden beteg részt vett egy strukturált, betegen kívüli cukorbetegség-képzési programban, amely három 2-h csoportból állt egy hét alatt 5-8 beteg számára. Általában azt tanították, hogy minden étkezéskor minőségi szénhidrátbevitelt feltételező étrendet kövessenek, bár azoknál a betegeknél, akik változtatni akartak, szénhidrátszámlálást kellett végezni., A betegek megismerték a bazális-bolus terápia kezelését és azt is, hogy hogyan állítsák be a bazális inzulin adagokat az éhomi önellenőrző vércukorszint (SMBG) szerint 7 naponta. A prandialis inzulin adagját az étkezés előtti értékeknek megfelelően, egy egyszerű algoritmus segítségével, meghatározott adag gyors hatású inzulinnal módosítottuk. A betegek követni látogatások által a nővér, 1, 3 hét, 3, 6 hónapos, illetve az endokrinológus a 2, 4, 7 hónapos, ahol a diéta ellenőrzött, naplót a SMBG értékek volt felül, hogy állítsa be az inzulin adagok., Antropometriai adatokat (súly, testtömeg-index és derékbőség), valamint kezelési és biokémiai változókat kaptak a vizsgálat megkezdésekor és 3 és 6 hónapon belül minden betegnél. Számszerűsítettük az inzulinigényt és a súlyos hypoglykaemia számát (A meghatározás szerint segítséget igényel) az anamnézis és a betegek naplóinak áttekintése alapján.
a HbA1c-t nagy teljesítményű folyadékkromatográfiával (HPLC) (Bio-Rad Laboratories, München, Németország) határozták meg, 4,6–5,8% referenciatartományban., A koleszterint és a triglicerideket standardizált enzimatikus módszerekkel és nagy sűrűségű lipoprotein koleszterinnel (HDLc) határozták meg közvetlen módszerrel (Roche Diagnostics, Basel, Svájc). Az alacsony sűrűségű lipoprotein koleszterint (LDLc) a Friedewald képlettel (ha a trigliceridszint
3, 39 mmol/l) vagy ultracentrifugálással becsülték meg. Az Apolipoprotein (Apo) B-t egy inmunoturbidimetriás módszerrel (Tina-quant, Roche diagnosztika) és LDL mérettel határozták meg elektroforézissel (2-16%)., Az életminőséget egy olyan betegségspecifikus kérdőív segítségével mérték, amelyet Spanyolországban A Diabetes Quality of Life (DCCT) alapján adaptáltak a vizsgálat megkezdésekor, és amelyet a basal-bolus inzulinterápia után 6 hónappal megismételtek.3,4
az adatokat az SPSS 15.0 statisztikai program (SPSS Inc.). Az antropometriai változók változásait, a HbA1c-t, az inzulinszükségletet és a lipidprofilt T-vel értékelték. Jelentős p≤0,05 értéknek tekintették őket.
eredmények
a kiindulási klinikai jellemzőket az 1. táblázat foglalja össze., Hetvennyolc százaléka beteg kezelés alatt 2 adag NPH vagy kevert inzulin készítmények, 11% – a beteg szájon át gyógyszerek, lefekvés előtt inzulin (glargine, detemir vagy NPH), a fennmaradó 11% – a beteg használja, egyéb kezelések, 3 adag NPH rendszeres inzulin. A betegek nyolcvanhét százalékában volt HbA1c koncentráció >8% és 51% – ban HbA1c> 9%. A bazális-bolus terápiára való áttérés után a HbA1c 3 hónap alatt 9±1,2% – ról 8,1±1,2% – ra (p
0,001), 6 hónap alatt 8,0±1,2% – ra (P0.001) csökkent (1.táblázat, 1. ábra). 1)., A≥9% HbA1c-ben szenvedő betegek aránya a kezdeti 51% – ról (19 beteg) 13,8% – ra, illetve 18,9% – ra csökkent a 3.és 6. hónapban. Fig. 2 a hba1c7%-os, 7-8% – os és >8% – os betegek arányát mutatja a basal-bolus terápiára való átállás előtt és után. A betegek közül ötben romlott a HbA1c érték. Csak egy súlyos hipoglikémiás epizód volt regisztrálva. 6 hónap elteltével minden beteg képes volt módosítani a bazális inzulin adagját, de csak 10 beteg változtatta meg önállóan a prandiális adagot az SMBG mintáinak megfelelően.,
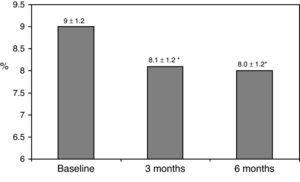
Glycated hemoglobin at baseline and 3 and 6 months after switching to basal-bolus regimen. *p0.001 compared to baseline. HbA1c: glycated hemoglobin.
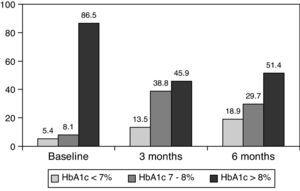
Percentage of patients with glycated hemoglobin 8% at baseline, and 3 and 6 months after switching to basal-bolus regimen.
testtömeg, inzulinszükséglet és lipidparaméterek a vizsgálat megkezdésekor és a nyomon követés során az 1.táblázatban láthatók. A testtömeg a követés 6 hónapja alatt stabil maradt, és az inzulinszükséglet (UI / ttkg / nap) nem változott a 3.hónapban, és enyhén emelkedett a 6. hónapban. Az LDL-részecskék mérete jelentősen nőtt 3 (25,77±0,48 nm vs 25,98±0,5 nm, p0.05) és 6 hónap (25,77±0,48 nm vs 25,94±0,44 nm, p0.05), míg a többi lipidparaméter nem változott., Vita
a jelen vizsgálatban azt mutattuk, hogy a bazális-bolus inzulinkezelés lehetővé teszi a glikémiás kontroll javulását anélkül, hogy veszélyeztetné a biztonságot és az életminőséget a hosszú távú 2-es típusú cukorbetegségben szenvedő, korábban egy vagy több inzulinadaggal kezelt betegeknél. Ezen inzulinrendszerek megvalósíthatóságát egy strukturált betegen kívüli képzési program segítségével is bemutatjuk.,
a 2-es típusú cukorbetegség kezelésére vonatkozó konszenzus iránymutatások úgy vélik, hogy a kezelés elsődleges célja a lehető legalacsonyabb HbA1c koncentráció elérése anélkül, hogy elfogadhatatlan hipoglikémiát okozna, különösen idősebb betegeknél vagy koszorúér-betegségben, valamint a mikrovaszkuláris és makrovaszkuláris szövődmények kialakulásának megelőzése.1,5 sajnos a legújabb felmérések azt mutatják, hogy a cukorbetegek nagy része nem teljesíti az ajánlott glikémiás célokat.,6,7 bár az Országos Egészség-és Táplálkozástudományi vizsgálat (NHANES) során a HbA1c
7%-os betegek aránya az 1999-2000-es 37% – ról 2003-2004-ben 56,8% – ra nőtt, a szuboptimális glikémiás kontroll aránya különösen magas azoknál az egyéneknél, akik hasonló tulajdonságokkal rendelkeznek, mint az általunk vizsgált betegek, akik régóta cukorbetegségben vagy inzulinkezelésben szenvednek.,6,7 naponta kétszer NPH vagy premix inzulin adagolást alkalmaznak az inzulin adagolási rend egyszerűsítésére, de korlátozott rugalmassággal rendelkeznek, a rendszeres étkezések merev betartását igénylik, korlátozzák az egyes komponensek adagjainak beállítását és növelik a hypoglykaemia lehetőségét. Így, bár sok beteg kezdetben megfelelő glikémiás kontrollt fog elérni ezzel a kezeléssel, 8 ha a béta-sejtek inzulinszekréciós kapacitása elvész, és az inzulinhiány súlyos, a glikémiás kontroll gyenge és instabil lesz, mint a jelen vizsgálatban részt vevő betegek többségében.,1,8 azt mutattuk, hogy hosszú távú, 2-es típusú cukorbetegségben szenvedő, más inzulinkezeléssel és instabil profillal rosszul kontrollált betegek esetében a bazális-bolus inzulinkezelés 6 hónap alatt egy ponttal csökkenti a HbA1C-t, és a HbA1c≥9% – os betegek aránya 3 hónap alatt 51% – ról 14% – ra, 6 hónap alatt pedig 19% – ra csökken. Ez valószínűleg azért van, mert fiziológiás terápia; míg a prandiális inzulin helyettesíti az első fázisú endogén inzulinszekréciót, a bazális inzulin csökkenti az éhomi hiperglikémia szintjét., Így amellett, hogy a szint HbA1c 9 ahogy a kezelés fokozódik nagyban megváltoztatja a relatív hozzájárulások bazális és posztprandiális hiperglikémia az Általános hiperglikémia T2DM betegek. Nemrég, Riddle et al.A 10 azt mutatta, hogy az inzulinnal történő kezelés intenzívebbé válása után a bazális hiperglikémia hozzájárulása csökken, de még mindig a maradék hiperglikémia körülbelül egyharmadát teszi ki. Ezért a jelen tanulmány eredményei szerint a bazális és a prandiális inzulint kombináló inzulinrendszerek alkalmazása gyakran szükséges a glikémiás célok eléréséhez., Sőt, ezek az eredmények összhangban vannak a hatalmas bizonyíték az az előnye, basal-bolus terápia 1-es típusú cukorbetegség 11., valamint támogatja a korlátozott adatok a megfigyeléses vizsgálatok a szenvedő 2-es típusú váltás a premix basal-bolus glargine-alapú rend 12,13, valamint egy randomizált összehasonlító egy premix-alapú rend ellen bazális-bolus kezelés 2-es típusú diabéteszes betegeknél.2,14,15 azoknál a betegeknél, akiket korábban glarginnal és orális antidiabetikumokkal kezeltek, a HbA1c különbség 0 volt.,22% a bazális-bolus glargin alapú kezelés mellett, szemben a premix inzulin adagolási renddel.15 A JOBB tanulmányi,14 betegek alcsoportjában korábban a bazális rend mutatott nagyobb HbA1c csökkentése a detemir/aspart basal-bolus rend képest kétfázisú aszpart inzulin (-1.21% vs -0.75%). Végül, a premix-szel kezelt 2-es típusú diabéteszes betegeknél, Fritsche et al. azt mutatta, hogy a bazális bolus glargin/glulizin alapú inzulinkezelés jobb volt a premix inzulinkezelésnél a HbA1c csökkentésében (-1,31% vs 0,8%).,2 ezért, bár a vizsgálatok között különbségek vannak a javulás nagyságrendjében, valószínűleg a vizsgált populáció különböző kiindulási jellemzői miatt, úgy tűnik, hogy a bazális-bolus kezelés felülmúlja a régóta fennálló betegségben szenvedő betegeket. A bazális bolus inzulinkezelésre való átállással elért több HbA1c-pont csökkenése klinikailag jelentősnek tekinthető, mivel ez a klinikai eredmények csökkenését eredményezheti., Sajnos, basal-bolus terápia alulhasznált betegeknél T2DM, mert az orvosok úgy vélik, hogy bonyolult végrehajtani, ez időigényes, és vannak félelmek a megnövekedett injekciók száma, a hypoglykaemia kockázata, súlygyarapodás, romló életminőség. Ebben és a korábbi vizsgálatokban a testtömeg és a súlyos hypoglykaemia aránya nem emelkedett,2,12, ami összefügghet a bazális-bolus kezeléssel történő fiziológiás inzulinpótlással, valamint azzal a rugalmassággal, amelyet ez a terápia a betegek számára kínálhat., Így a hipoglikémia félelme nem akadályozhatja az ilyen típusú terápia megkezdését a T2DM-ben, de figyelembe kell venni a glikémiás kontroll célok megállapítása érdekében, mivel ez morbiditást és fokozott mortalitást okozhat.16 az életminőségre gyakorolt hatás tekintetében, összhangban a Ménard et al. jelentésével., 17 tanulmányunk nem támogatta azt a nézetet, hogy a bazális-bolus kezelések csökkent életminőséghez vezetnek.
egy korábbi jelentés szerint a jelen vizsgálatban 12 beteg tudta titrálni a bazális inzulin adagját az elmúlt 3-7 nap éhgyomri SMBG-jének megfelelően., Ezzel szemben kevés beteg volt képes az SMBG mintáinak megfelelően beállítani a prandiális inzulinadagokat, és a premeális vércukorszinttől függően egy egyszerű algoritmus támogatására volt szükség. Ez nem meglepő, hiszen létrehozó az optimális etetés inzulin adag gyakran magában foglalja a számítások szerint több tényező pedig nehéz néhány beteg számára. Továbbá, egy egyszerű algoritmus segítségével az étkezési gyorshatású inzulint hetente az SMBG minták alapján állíthatjuk be, ugyanolyan hatékony, mint az étkezési inzulin beállítása az inzulin-szénhidrát arányok alkalmazásával T2DM alanyokban.,18
a vizsgálat korlátai a prospektív megfigyelési tervhez és a kontrollcsoport hiányához kapcsolódnak. Ezeket a szempontokat és a betegek rövid nyomon követését, nehéz értelmezni a megállapításokat és alkalmazhatóságukat a T2DM-ben szenvedő betegekre, más központokban követték. Azonban, bár a későbbi vizsgálatok nagyobb betegcsoportok kell végezni, hogy erősítse meg ezeket a megállapításokat, a tanulmány olyan információkat nyújt, amelyek hasznosak lehetnek a kezelés egy közös, rosszul kezelt klinikai helyzet.,
A következtetés, hogy a jelen tanulmány kimutatta, hogy egy 9 órás ambuláns program lehetővé tette, hosszú időtartama T2DM betegek rosszul beállított más inzulin kezelésben váltani basal-bólus inzulin kezelés. Megerősítettük azt is, hogy a bazális-bolus inzulinkezelés hatékony, biztonságos és nem változtatja meg az életminőséget a T2DM-es betegek ezen alcsoportjában. Így a bazális-bolus terápiát más inzulinstratégiákkal nem megfelelően kontrollált T2DM-es betegek számára is fel lehet ajánlani.
összeférhetetlenség
Irene Vinagre előadási díjat kapott az Eli Lilly, a Novo Nordisk és a Sanofi Aventis., Antonio Perez az Eli Lilly-től, a Novo Nordisk-tól és a Sanofi Aventis-től kapott színjáték-és előadásdíjat.