Tanulási Célok
- Define korrózió
- Lista néhány módszert használják, hogy megakadályozzák vagy lassú korrózió
Korrózió általában meghatározott a bomlás fémek miatt egy elektrokémiai folyamat. A rozsda kialakulása a vason, az ezüst elszíneződése, valamint a rézen kialakuló kék-zöld patina mind a korrózió példái., A korrózió teljes költsége az Egyesült Államokban jelentős,becslések szerint évente több mint fél billió dollár.
talán a korrózió legismertebb példája a rozsda kialakulása a vason. A vas rozsdásodik, ha oxigénnek és víznek van kitéve. A vas rozsdásodásának fő lépései a következőket foglalják magukban (2.ábra). A légkörnek való kitettség után a vas gyorsan oxidálódik.
az elektronok savas oldatokban csökkentik a levegő oxigénjét.
hívjuk rozsda hidratált vas(III) – oxid, amely akkor alakul ki, ha a vas(II) ionok reagálnak további oxigénnel.,
A számot, a víz molekulák változó, így képviseli x. Ellentétben a patina, a réz, a rozsda kialakulását nem hoz létre egy védőréteget, így a korrózió a vas továbbra is, mint a rozsda pelyhek le elkeserítő, friss vas a légkörbe.
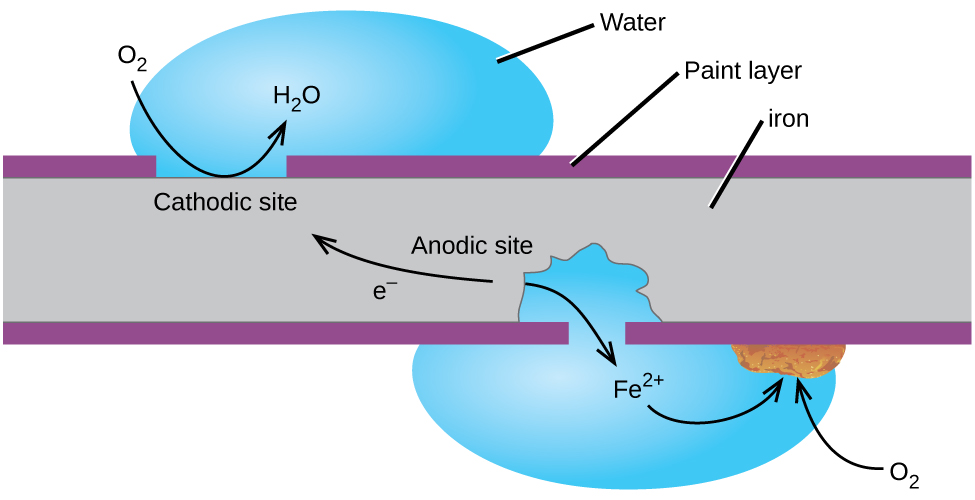
a vas korrodálásának egyik módja, hogy festett maradjon. A festékréteg megakadályozza, hogy a rozsda kialakulásához szükséges víz és oxigén érintkezzen a vassal. Mindaddig, amíg a festék sértetlen marad, a vas védett a korróziótól.,
egyéb stratégiák közé tartozik a vas ötvözése más fémekkel. Például a rozsdamentes acél többnyire vas, kis krómmal. A króm hajlamos összegyűjteni a felület közelében, ahol oxidréteget képez, amely védi a vasat.
A horganyzott vagy horganyzott vas más stratégiát alkalmaz. A cink könnyebben oxidálódik, mint a vas, mert a cink alacsonyabb redukciós potenciállal rendelkezik. Mivel a cink alacsonyabb redukciós potenciállal rendelkezik, aktívabb fém. Így még akkor is, ha a cink bevonat karcolódik, a cink még mindig oxidálódik a vas előtt., Ez arra utal, hogy ennek a megközelítésnek más aktív fémekkel kell működnie.
a fém védelmének másik fontos módja az, hogy a katód egy galvanikus cellában legyen. Ez katódos védelem, amely a vas kivételével más fémekhez is használható. Például a földalatti vas tároló tartályok és csövek rozsdásodása megakadályozható vagy jelentősen csökkenthető azáltal, hogy aktívabb fémhez, például cinkhez vagy magnéziumhoz csatlakoztatja őket (3.ábra). Ezt a vízmelegítők fémrészeinek védelmére is használják., Az aktívabb fémeket (alacsonyabb redukciós potenciált) áldozati anódoknak nevezik, mivel az anódban korrodálódnak (oxidálódnak). A védett fém katódként szolgál, így nem oxidálódik (korrodálódik). Az anódok megfelelő ellenőrzése és rendszeres cseréje esetén a vas tároló tartály hasznos élettartama jelentősen meghosszabbítható.
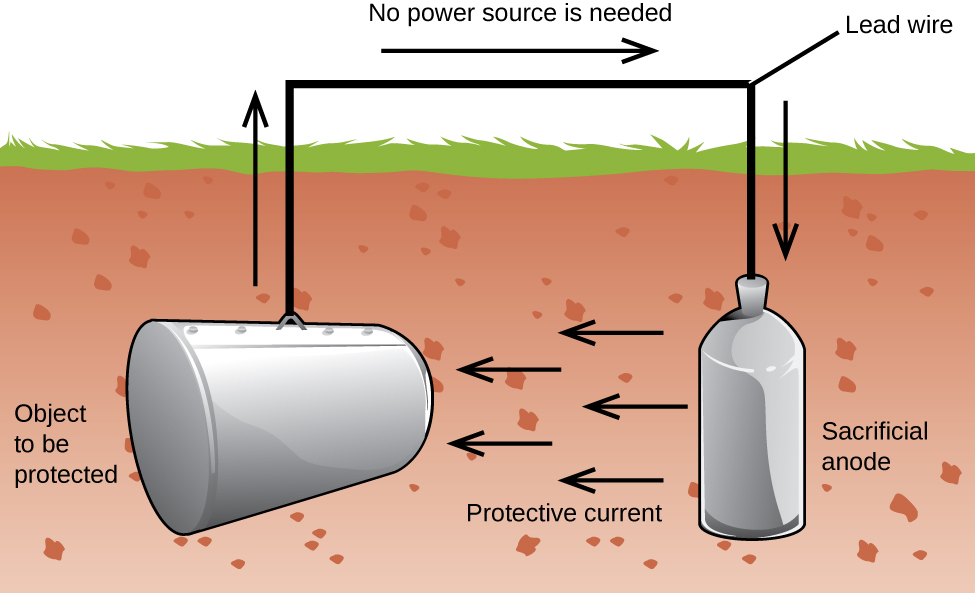
a korrózió egy elektrokémiai folyamat által okozott fém lebomlása. Évente nagy összegeket költenek a korrózió hatásainak javítására vagy megelőzésére. Egyes fémek, mint például az alumínium és a réz, védőréteget termelnek, amikor a levegőben korrodálnak., A fém felületén kialakuló vékony réteg megakadályozza, hogy az oxigén több fématommal érintkezzen, így “megvédi” a fennmaradó fémet a további korróziótól. A vas korrodálódik (rozsdát képez), ha víznek és oxigénnek van kitéve. A rozsda, hogy képződik a vas fém pelyhek le, kiteszik a friss fém, amely szintén korrodálja. A korrózió megelőzésének vagy lassításának egyik módja a fém bevonása. A bevonat megakadályozza, hogy a víz és az oxigén érintkezzen a fémmel. A festék vagy más bevonatok lassítják a korróziót, de nem hatékonyak, ha karcolódnak., A horganyzott vagy horganyzott vas kihasználja azt a tényt, hogy a cink nagyobb valószínűséggel oxidálódik, mint a vas. Mindaddig, amíg a bevonat megmarad, még akkor is, ha karcolódik, a cink oxidálódik a vas előtt. A fémek védelmének másik módja a katódos védelem. Ebben a módszerben egy könnyen oxidált, olcsó fém, gyakran cink vagy magnézium (az áldozati anód), elektromosan csatlakozik a védendő fémhez. Az aktívabb fém az áldozati anód, a galvanikus sejt anódja. A “védett” fém a katód, oxidálatlan marad., A katódvédelem egyik előnye, hogy az áldozati anódot szükség esetén monitorozni és kicserélni lehet.,
Szójegyzék
katód-védelem módszer a védő fém segítségével egy áldozati anód meg hatékonyan, hogy a fémet, hogy meg kell védeni a katód, így megakadályozza, hogy az oxidáció korrózió bomlás fém keresztül egy elektrokémiai folyamat, horganyzott vas módszer védi a vas által, amely a cink, ami a szórás, mielőtt a vas, cink bevonatú vas áldozati anód aktívabb, olcsó fém használni, mint az anód a katód-védelem; gyakran a magnézium vagy a cink
Megoldás
a Választ, hogy a Kémia Végén Fejezet Gyakorlatok
2., Mg és Zn
4. Mindkét példa magában foglalja a katódos védelmet. Az (áldozati) anód az a fém, amely korrodálódik (oxidálódik vagy reagál). A vas (-0,447 V) és a cink (-0,7618 V) esetében a cink negatívabb standard redukciós potenciállal rendelkezik, így anódként szolgál. A vas és a réz (0,34 V) esetében a vas kisebb standard redukciós potenciállal rendelkezik, így korrodálódik (anódként szolgál).
6., Míg a lítium redukciós potenciálja lehetővé tenné a többi fém védelmét, ez a nagy potenciál azt is jelzi, hogy a reaktív lítium milyen; spontán reakció lenne a legtöbb anyaggal. Ez azt jelenti, hogy a lítium gyorsan reagálna más anyagokkal, még azokkal is, amelyek nem oxidálják a védeni kívánt fémet. Az ilyen reaktivitás azt jelenti, hogy az áldozati anód gyorsan kimerül, és gyakran ki kell cserélni. (Opcionális kiegészítő ok: tűzveszély víz jelenlétében.)