Introduction
Nuclear factor kappa B (NF-kB) is an ancient protein transcription factor (Salminen et al., 2008) és a veleszületett immunitás szabályozójának tekintették (Baltimore, 2009). Az NF-kB jelátviteli útvonal összekapcsolja a patogén jeleket és a sejtes veszélyjeleket, ezáltal megszervezve a sejtek ellenállását a behatoló kórokozókkal szemben., Valójában számos tanulmány kimutatta, hogy az NF-kB egy komplex biológiai jelátvitelért felelős hálózati csomópont (Albensi and Mattson, 2000; Kaltschmidt and Kaltschmidt, 2009; Karin, 2009). Ebből a célból az NF-kB-t feltételezték, hogy az evolúciósan konzervált biokémiai kaszkádok fő szabályozója (Mattson et al., 2000). Más tényezők is átkerülnek a mitokondriumokba, és részt vesznek az expresszió modulálásában (Barshad et al., 2018A), de nem a felülvizsgálat középpontjában állnak., Ennek a felülvizsgálatnak az a célja, hogy megpróbálja megérteni, hogy az NF-kB aktivitás hogyan járul hozzá a mitokondriális funkcióhoz. Feltételezzük, hogy az olvasó már megérti az alapvető mitokondriális biológiát. További tanulmányok esetében az olvasót számos kiváló tanulmányra és áttekintésre utalják a mitokondriális szerkezetről és funkcióról (Hall, 1979; Fox, 1982; Roger and Silberman, 2002; Henze and Martin, 2003; Conradt, 2006; Ettema, 2016; Wang and Youle, 2016; Barshad et al., 2018b).,
NF-kB aktiválás
az NF-kB komplexből álló nukleáris faktor kappa B alegységei mind neuronokban, mind glia-ban expresszálódnak. Az NF-kB komplex inaktív állapotban létezik a citoplazmában (Ghosh et al., 1998; Aggarwal et al., 2004; Hayden and Ghosh, 2004), ahol az NF-kB aktiválását jól leírták (Li and Karin, 2000; Baud and Jacque, 2008; Izrael, 2010). A TNFa molekulák, például TNFa vagy más sejtstresszorok stimulálása esetén a TNFa kötődik a TNF receptorokhoz (1.ábra)., Ez a kötés több közbenső lépésen keresztül kölcsönhatást eredményez az IkB kináz (IKK) komplexummal, amely ezután az IkB foszforilációjához vezet, majd IkB ubiquitinációt és lebomlást eredményez. A degradáció után a fennmaradó NF-kB dimer (például p65/p50 alegységek) átkerül a magba, ahol kötődik a különböző célgének DNS-konszenzus szekvenciájához. Az NF-kB válasz szelektivitása több tényezőn alapul (Sen and Smale, 2010), beleértve a dimer összetételt, az időzítést és a sejttípust., Az NF-kB sejt túlélésre gyakorolt hatása szintén összetett, és lehet neuroprotektív vagy proinflammatorikus is, a sejttípustól, fejlődési stádiumtól és kóros állapottól függően (Qin et al., 2007).
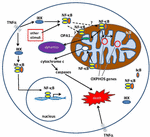
1.ábra. A citoplazmában és a mitokondrionban a nukleárisfaktor κ b (NF-kB) jelátviteli útvonalai. Az NF-kB Tri – subunt komplex (például p65, p50, IkB-egy lehetséges kombináció) inaktív állapotban létezik a citoplazmában. Az NF-kB aktiválás akkor kezdődik, amikor olyan molekulák, mint a TNFa, kötődnek a TNF receptorokhoz (különböző típusok léteznek)., Más külső vagy belső ingerek is aktiválhatják az NF-kB-t. Egy bonyolult jelátalakítási folyamat akkor kezdődik, amikor a TNF receptorok aktiválódnak; IkB kináz (IKK) végül aktiválódik, és vezet a foszforiláció IkB, ami IkB ubiquitination és lebomlás. Miután az IkB lebomlik, a fennmaradó NF-kB dimer (például p65/p50 vagy p50/p50 alegység kombinációk lehetségesek) transzlokálódik a magba, ahol kötődik a célgének DNS-konszenzus szekvenciájához., A nem jól ismert folyamatok alapján az NF-kB komplex vagy az NF-kB alegységek a mitokondrionba is vándorolhatnak, ahol a bizonyítékok azt sugallják, hogy elfoglalják az intermembrán teret. A mitokondriumok belsejében úgy gondolják, hogy az NF-kB kölcsönhatásba lép az OXFOS génekkel (mitokondriális mtDNS), amelyek különböző funkciókban részt vevő fehérjék expressziójához vezetnek, beleértve a mitokondriális dinamikát és a COX III szabályozást (a komplex IV összetevője)., A bizonyítékok arra is utalnak, hogy az NF-kB a mitokondriumok átkapcsolásaként működhet, és szabályozhatja az egyensúlyt a citoplazmatikus glikolízis és a mitokondriális légzés hasznosítása között a normál sejtekben és a rákban. Végül az adatok arra is rámutatnak, hogy intrinsic apoptotikus útvonal stimuláció, ahol NF-kB aktiválás a mitokondriumok vezet citokróm C kiadás, így kiváltó kaszpáz kaszkádok és programozott sejthalál.,
Szervezetileg, az NF-kB egy Rel családi transzkripciós faktor, valamint a kapcsolódó öt gének, NF-kB1, NF-kB2, NYUGI, RELB, valamint REL (Chen, valamint Greene, 2004); ezek a gének kódolják több fehérjék, NF-kB1, NF-kB2, Nyugi, RelB, c-Rel, illetve ahol két ilyen fehérjék nagy prekurzor fehérjék ismert p105, valamint p100, hogy részt proteolysis lesz p50, valamint p52, ill. Ezek a fehérjék REL-homológiai doméneket (RHD) tartalmaznak az amino-terminális régiójukban; az RHD Régió 2 különálló, de szomszédos doménből áll., A karboxi-terminális régiótól legtávolabbi szekvencia lehetővé teszi a fehérje kötődését a DNS-hez. A belső szekvencia lehetővé teszi, hogy a Rel család fehérjéi dimerizálódjanak (homo – vagy heterodimerek) az expresszió elnyomására a megfelelő inhibitorcsalád, az IkB fehérjék kötődése révén (Chen and Greene, 2004). Ez utóbbi szekvencia magában foglalja a nukleáris lokalizációs szekvenciát (NLS), amely lelepleződik, amikor az IkB nem kötődik a lebomláshoz. Az NLS feladata az aktív fehérjék irányítása vagy címkézése a sejtmagba történő behozatalhoz (Chen and Greene, 2004; Karin et al., 2004; Barger et al.,, 2005).
Ezen fehérjék közül három (RelA, RelB és c-REL) egy transzaktivációs domént (TADs) is kódol a karboxi-terminális régiójukban. A TADs lehetővé teszi, hogy ezek a fehérjék kölcsönhatásba lépjenek a bazális transzkripciós készülékkel, az úgynevezett Tata kötő protein (TBP), az IIB transzkripciós faktor, valamint a p300 és cAMP response element (CREB) kötő protein (CBP) transzkripciós koaktivátorok (Chen and Greene, 2004)., Csak ez a három fehérje képes a DNS-kódoló régiók transzkripcióját kiváltani, míg a többi fehérje, a p50 és P52 homodimerek képesek a DNS-kötőhelyek elfoglalására transzkripció kezdeményezése nélkül. Ezt figyelembe véve a későbbi 2 homodimer P50 és P52 fehérje transzkripciós represszorként működik (Chen and Greene, 2004).
a P105 és p100 homodimerek DNS-kötőhelyeket foglalnak el, így gátolják a transzkripciót olyan transzkripciós tényezőkön keresztül, amelyek TADs-szel rendelkeznek (Barger et al., 2005). A transzkripciós elnyomás harmadik formája az IkB fehérjéknek köszönhető., Ezeknek a fehérjéknek több ankyrin-ismétlése van, mint a magtartományuk, és úgy működnek, hogy az NLS-t maszkoló RHD-hez kötődnek (Karin et al., 2004). Aktív NLS nélkül az NF-kB fehérjék a citoplazmára korlátozódnak, és képtelenek a sejtmagba vándorolni, így a transzkripció blokkolva van.
NF-kB megtalálható a mitokondriumok
2001-ben, egy tanulmány szerint Bottero et al. (2001) Az IkBa-t és az NF-kB p65 alegységet szubcelluláris frakciókban és a Jurkat sejtekből tisztított mitokondriumokban találták meg. A Jurkat sejtek az emberi T-limfocita sejtek halhatatlanná vált sejtvonala, amelyet leukémia tanulmányozására használnak., Bottero tanulmányában megállapították, hogy az IkBa és az NF-kB p65 a mitokondriális intermembrán térben lokalizálódott. A mitokondriális intermembrán tér a belső mitokondriális membrán (IMM) és a külső mitokondriális membrán (OMM) között létező tér.
később, Cogswell et al. (2003) azt is kimutatta, hogy az NF-kB alegységek, a P50 és a P65, valamint az IkBa a mitokondriumokban találhatók. Ennek meghatározásához számos módszert alkalmaztak a bizonyítékok benyújtására, beleértve az u937 sejtek szakaszainak elektronmikroszkópiáját., Az U937 sejteket először egy középkorú férfi beteg limfómájából izolálták, hogy tanulmányozzák a monociták viselkedését és differenciálódását. Itt Cogswell et al. (2003) a mitokondriumok belső mátrixában képes volt megjeleníteni az NF-kB p50 és P65 alegységeket és IkBa-t. Ebben a vizsgálatban patkánymájsejteket is vizsgáltak, valamint a P50 alegységet és az IkBa alegységet is azonosították. Ezenkívül az U937 sejteket 1 órán keresztül stimulálták a TNFa-val, amely az NF-kB jelátviteli út ismert kiváltója., Ebben a kísérletben a mitokondriális és citoplazmatikus frakciók Western blot analízisei azt találták, hogy a TNFa-kezelés az IkBa elvesztését okozta mind a mitokondriális, mind a citoplazmatikus rekeszekben 30 perccel a kezelés után, ami arra utal, hogy az IkBa lebomlik. A TNFa-val stimulált U937 sejtekből izolált mitokondriumok nukleáris kivonataiból vett Proteinen az EMSA analízist, egy in vitro vizsgálatot, amely az NF-kB aktivációt és a DNS-szekvenciákhoz való nem specifikus kötődést érzékeli., Itt megállapították, hogy a TNFa jelátvitel az NF-kB p50 fokozott DNS-kötési aktivitásához vezetett, a mitokondriumokból vett fehérjékben.
más vizsgálatok is kimutatták az NF-kB-t a mitokondriumokban. Ezek közé tartoznak a vizsgálatok (Guseva et al., 2004; Zamora et al., 2004) humán fibroblast HT1080 sejtvonalakban, humán prosztata LNCaP és PC3 sejtvonalakban és HeLa sejtekben. Az LNCaP sejtekben a mitokondriumok NF-kB p50 és P65 alegységei mitokondriális DNS-hez (mtDNS) kötődnek., Ezek a vizsgálatok együttesen bizonyítják az NF-kB jelátvitelét a mitokondriumokban, valamint azt, hogy az NF-kB szabályozza a mitokondriális mRNS expressziót (lásd az NF-kB és a mitokondriális génexpresszió részt alább).
NF-kB szabályozza a mitokondriális dinamikát
számos fehérje vesz részt a mitokondriumok dinamikájában (hasadás és fúzió) és morfológiájában (Karbowski and Yole, 2003; Olichon et al., 2006; Brooks and Dong, 2007; Song et al., 2008; Autret and Martin, 2010; Silva et al., 2013; Sinha és Manoj, 2019). Ezek egyike az optic atrophia 1 protein (OPA1) (Olichon et al.,, 2006; Garcia et al., 2018; Lee and Yoon, 2018). Tanulmányok azt sugallták, hogy az OPA1 a mitokondriális belső membránfúzió szabályozója, valamint a mitokondriális cristae remodeling (Cipolat et al., 2006). Nemrég Laforge et al. (2016) kimutatta, hogy az IKKa hiánya hatással volt az OPA1 kifejezésre a mitokondriumokban és a mitokondriális morfológiában.
meglepő módon A Nan et al. (2017) a TNFa receptor 2 (TNFR2) stimulációt úgy találták, hogy elősegíti a mitokondriális fúziót az OPA1 expresszió NF-kB-függő aktiválásával a szív myocitákban., Fontos, hogy a tnfr2 aktiválása ebben a vizsgálatban az opa1 expresszió szabályozásával védte a szív myocitáit a stressz ellen. Alacsony exogén TNFa (0,5 ng/mL) koncentrációk beadásával az ischaemia előtt-a reperfúzió úgy tűnt, hogy fokozza a sejtek túlélését, míg a magasabb koncentrációk (10-20 ng/mL) toxikus hatásokhoz vezettek a sejtekben.
NF-kB és apoptózis a mitokondriumokban
a mitokondriumok szerepe a programozott sejthalálban, vagy az apoptózis már jó ideje ismert (Green and Reed, 1998; Wang and Chen, 2015)., A mitokondriumok legfontosabb szerepe az ATP generációja; azonban a mitokondriumok második legfontosabb funkciója valószínűleg a sejthalál szabályozásában van. Hogyan csinálja ezt a mitokondrion? Ha a mitokondrion nem váltja ki a sejthalált, a rák gyakran a következménye. Tehát a sejthalál szabályozása érdekében a mitokondriumok számos forrásból származó jeleket integrálnak, amelyeket az apoptózis belső útjainak neveznek. Úgy tűnik, hogy az NF-kB aktivitás összetevői egyike ezeknek a jeleknek, bár a TNFa, az NF-kB aktivátor, az apoptózis extrinsikus útjának része., Külső utak (halál-receptor-mediált) indított kívül a cellában, míg a belső utak apoptózis közvetítését, de megszólalt a mitokondriumok.
Pazarentzos et al. (2014) Az IkBa pro-apoptotikus aktivitást fejtett ki, mivel gátolta az anti-apoptotikus NF-kB-t. A legtöbb sejtben az NF-kB aktiválása downstream célgén expresszióhoz vezet, amely kiváltja a sejthalál-rezisztenciát (Luo et al., 2005). Ebben a tanulmányban kimutatták, hogy egy új apoptózis funkció az IkBa-nak, az alegységnek köszönhető, amely gátolja az NF-kB aktiválását. Pazarentzos et al., (2014) megállapította, hogy IkBa helyhez kötött, hogy az OMM, ahol kölcsönhatásba lép egy feszültség-függő anion csatorna (VDAC), valamint a mitokondriális hexokináz II. (HKII) stabilizálja ez a komplex, illetve megakadályozzák a Bax-mediált citokróm c bocsátás apoptózis. Bax tagja a Bcl-2 család fehérjék, amelyek kimutatták, hogy szabályozók programozott sejthalál (Karbowski et al., 2006).
más tanulmányok is utaltak az NF-kB szerepére a mitokondrion apoptózisának közvetlenebb szabályozásában. Egy tanulmány szerint Liu et al., (2004), gátolja az NF-kB egyedül a makrofágok eredményezte, hogy a kiadás a citokróm c. Emlékezzünk vissza, hogy a citokróm c felelős ingáznak az elektronok a Komplex III. Komplex IV., hogy a kiadás a citokróm c a citoplazmában, egy aktivátor a caspases, kulcsfontosságú lépés kiváltó apoptózis.
NF-kB és mitokondriális légzés
Nuclear factor kappa B számos vizsgálatban kimutatták, hogy elősegíti a tumorigenesist. Hogy ez hogyan történik, nem volt pontosan világos. Egy úttörő tanulmány Mauro et al., (2011), az NF-kB-t úgy találták, hogy a mitokondriális légzést a vastagbél-karcinóma sejtekben szabályozza. Itt megállapították, hogy az NF-kB funkciója elnyomja a Warburg-hatást. Emlékezzünk vissza, hogy a Warburg hatás (Vander Heiden et al., 2009) leírja azt a megfigyelést, hogy a rákos sejtek inkább glikolízissel elősegítik az anyagcserét, nem pedig a hatékonyabb oxidatív foszforilációs úton. Tehát ebben a tanulmányban a szerzők megállapították, hogy az NF-kB energiacsere-hálózatokat szervez a glikolízis hasznosítása és a mitokondriális légzés egyensúlyának szabályozásával., Érdekes módon szerepet találtak az NF-kB-ban a metabolikus adaptációban a normál sejtekben és a rákban. Eredményeik arra utaltak, hogy a kialakult rákos sejtekben a mitokondriális metabolizmus elnyomása az NF-kB gátlása és a metformin csökkenti a tumorigenesist.
NF-kB és mitokondriális génexpresszió
A nukleáris faktor kappa B a génexpresszió ismert szabályozója-mind negatívan, mind pozitívan – Mattson et al., 2000). Kevésbé érthető azonban, hogy az NF-kB hogyan szabályozza vagy befolyásolja a nukleáris kódolású mitokondriális gén expresszióját., Az emberi mtDNA 37 génnel rendelkezik, amelyek 13 polipeptidet kódolnak. Kimutatták, hogy az mtDNA gének az elektronszállítási lánc (ETC) mind az 5 komplexének, a 2 rRNAs-nak és a 22 tRNAs alegységeinek számos alegységét kódolják. Bár a legtöbb ETC alegységet nukleáris DNS kódolja, amelyet befolyásolhat az NF-kB aktivitás (Calvo et al., 2016).
például azt állították (Cogswell et al., 2003), hogy az NF-kB útvonal negatívan szabályozhatja a COX III alegységhez kapcsolódó mitokondriális génexpressziót., A COX III alegységet az mtDNS kódolja, és a mitokondriális stb. Katalitikus alegységként működik a IV. komplexben,amely a mitokondriális oxigénfogyasztáshoz kapcsolódó komplex. Egy tanulmány szerint Cogswell et al. (2003) az NF-kB aktiválás modulációja mind a COX III, mind a citokróm B mRNS expressziójának elvesztését eredményezte. Más tanulmányok támogatják az NF-kB szerepét további mitokondriális gének, például a COX i és a Cytb szabályozásában (Psarra and Sekeris, 2008, 2009; Barshad et al., 2018b)., Ezenkívül az NF-kB P65 alegység csökkentette az mtDNA-kódolt CytB mRNS szintjét, esetleg a p53 hiányában az emberi sejtekben lévő D-hurokhoz való kötődéssel (Johnson et al., 2011). Összességében ezek az eredmények azt sugallják, hogy az NF-kB jelzés befolyásolhatja a légzőszervi stb.komplexek enzimatikus aktivitását.
NF-kB Közvetíti Aß Okozta Zavar a Mitokondriumok
az Alzheimer-kór (ak) társul a kiépítése Aß plakkok és/vagy a megjelenése neurofibrilláris (NFTs) bizonyos agyi régiókban (Duyckaerts et al., 2009)., Azonban vita merül fel arról, hogy az aß az AD kórokozója, vagy ha az Aß egyszerűen korrelál az öregedéssel. Gyűjtő bizonyítékok (Aliev et al., 2009; Correia et al., 2012; Cadonic et al., 2016; Cardoso et al., 2017; Djordjevic et al., 2017)az agy anyagcseréjének változásaira is rámutat, amelyet a mitokondriális diszfunkció hajt végre, mint számos korral összefüggő neurodegeneratív rendellenesség, köztük az AD központi folyamata. Ehhez a bizonyítékhoz hozzáadva az ETC fehérje komplexeinek enzimatikus aktivitása is károsodik, valamint az antioxidáns enzimatikus aktivitás változásai (Kolosova et al.,, 2017) Az AD. Különösen az AD (Mutisya et al., 1994).
egy nemrégiben készült tanulmány szerint Shi et al. (2014), azt találták, hogy az aß károsodott mitokondriális funkció NF-kB jelzéssel. Sőt, Shi et al. (2014) Itt kimutatta, hogy az aß csökkentette a COX III alegység kifejezését egy NF-kB útvonalon., Fontos, hogy kiküszöböljük annak lehetőségét, hogy az IkBa-t az aß foszforilálta a citoplazmában (majd a mitokondriumokba szállították), az izolált mitokondriumokat aß-vel inkubáltuk egy NF-kB blokkoló jelenlétében (vagy hiányában), nevezetesen a BAY11-7082-ben. Itt izolált mitokondriumokban találták meg az IkBa foszforilációját és lebomlását.
Ezek a megállapítások szintén fontos hatással vannak az AD-kezelésre, amint azt a Snow et al. (2018) és más kapcsolódó tanulmányok (Djordjevic et al., 2017; Adlimoghaddam et al.,, 2019), amelyek azt sugallják, hogy az NF-kB jelátvitel a mitokondriumokban terápiás értékkel bírhat. Például a Snow et al.a kreatin – a mitokondriális funkció ismert modulátorának (Tarnopolsky and Beal, 2001) a kreatinnal táplált egerekben a CaMKII, a PSD-95 és a Complex 1 alegységek fehérjeszintjét növelte és pozitívan módosította, míg az NF-kB gátló IkB alegység csökkent. A kreatin mitokondriális funkcióra gyakorolt lehetséges terápiás hatásáról, valamint mitokondriális rendellenességekről vagy egyéb neurológiai rendellenességekről szóló további információkért lásd Matthews et al., (1998), Klivenyi et al. (1999), Tarnopolsky and Beal (2001), Hersch et al. (2006), Rodriguez et al. (2007) és Beal (2011).
NF-kB szerepe a gyulladásban és a mitokondriális anyagcserében
növekvő adatok (Lamas et al., 2003; Mauro et al., 2011; Moretti et al., 2012) arra utal, hogy az NF-kB jelátvitel, amely a gyulladásos folyamatok közvetítője, szabályozóként és integrátorként is működik az energia anyagcserével. Egy nemrégiben készült tanulmány szerint Zhong et al. (2016) kimutatták, hogy az NF-kB korlátozza a gyulladásos aktivációt a sérült mitokondriumok eltávolításával., Meglepő módon úgy tűnt, hogy az NF-kB mind az nlrp-3 gyulladását aktiválta, mind pedig megakadályozta a túlzott gyulladást, valamint az nlrp-3 gyulladásos aktiválódását; bár a visszatartás mechanizmusa rosszul volt meghatározva. Itt azt feltételezték, hogy amellett, hogy az NF-kB a gyulladásos gének aktiválója, ebben a vizsgálatban az NLRP3 gyulladásos aktiválódásának és az IL-1β termelésének korlátozásával is működött. Ezenkívül azt találták, hogy a P62 indukció felelős az NF-kB gyulladásgátló aktivitásáért., Úgy tűnik, hogy az NF-kB korlátozhatja saját gyulladását a makrofágokban azáltal, hogy elősegíti a P62 által közvetített sérült mitokondriumok (mitofágok) eltávolítását, miután a makrofágok kölcsönhatásba lépnek a különböző nlrp3 gyulladásos aktivátorokkal.
következtetés
Több mint 10 évvel ezelőtt NF-kB-t észleltek a mitokondriumokban. Meglepő módon egy ilyen fontos transzkripciós tényező esetében kevés előrelépés történt az NF-kB-nak a mitokondriont érintő konkrét szerepeinek feltárásában., Egyes tanulmányok fent leírt nyújtanak bizonyítékot az NF-kB-ot, a mitokondriális dynamics, apoptózis, légzési központ, génexpresszió, valamint mechanizmusok betegség (1.Ábra). Ezen eredmények megkettőzése és az Általános érvényesítés azonban még mindig szükséges más laboratóriumok számára. A mitokondriumokban (Psarra and Sekeris, 2008) további betekintést nyerhetünk abból a tényből, hogy más, a nukleáris génekre, például AP-1, p53, CREB, c-Myc, Wnt13, Dok-4, HMGA1 és c-Src hatást gyakorló transzkripciós tényezőket is kimutattak., Érdekes módon a mitokondriális genomban található kötőhelyek (homológ a kötőhelyeikhez a nukleáris DNS-ben) ezen tényezők némelyike esetében meghatározásra kerültek (Psarra and Sekeris, 2008), ahol a mitokondriális transzkripció és apoptózis szerepe feltételezhető, és néhány általános aktivitási mintát mutatnak. Például egy érv lehet tenni, hogy ezek közül néhány tényező (NF-kB, CREB, és AP-1) kötődik a mitokondriális genomokhoz, és többnyire gyengíti a mitokondriális gén expresszióját (Blumberg et al., 2014), miközben stimuláló hatással van a nukleáris gén transzkripciójára., Egyértelmű azonban, hogy több munkára van szükség ahhoz, hogy ne csak a tevékenység pontos szerepeit találjuk meg, hanem annak meghatározására is, hogy a tevékenység általános mintái valóban léteznek-e.
a szakirodalom felmérése után az is nyilvánvalóvá válik, hogy az NF-kB szerepe a mitokondriális légzés szabályozásában mélyreható következményekkel jár, és olyan komplexitást mutat, amelyet korábban nem értékeltek. Például Mauro et al. (2011) Az adatok szerepet játszanak az NF-kB-ban a normál sejtekben és a rákban a metabolikus adaptációban, valamint más betegségekre, például az AD-re gyakorolt következményekre is utalnak., Továbbá, mivel az NF-kB korlátozhatja saját gyulladását, amint azt Zhong et al. (2016), nem csak meglepő, de tovább példázza az NF-kB jelátvitel összetettségét a mitokondriális funkcióban.
ebben a felülvizsgálatban tanulmányokat végeztek az NF-kB mitokondriális funkciójában betöltött szerepéről, és úgy tűnik, hogy a kutatás ezen a területen növekszik. Az eredmények bonyolítása azonban az a megfigyelés, hogy több tényező hasonló szerepet játszik a mitokondriális funkcióban, ezért az egyes tényezőkre jellemző részletes vizsgálatokra van szükség., Összefoglalva, újra feltehetjük a kérdést – mit csinál az NF-kB a mitokondrionban? Az azonnali, rövidített válasz lenne-sok!
szerzői hozzájárulások
a szerző létrehozta a témát, és megírta a kéziratot.
finanszírozás
ezt a munkát a Canadian Institutes of Health Research (CIHR), a Canadian Agricultural Partnership (CAP), a St. Boniface Hospital Research Foundation, Az Alzheimer Society of Manitoba, a Research Manitoba, a tiszteletreméltó Douglas és Patricia Everett, valamint a Royal Canadian Properties Limited Alapítvány támogatta.,
összeférhetetlenségi nyilatkozat
a szerző kijelenti, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
elismerések
a szerző köszönetet szeretne mondani Dr. Grant Hatchnak a kézirat felülvizsgálatáért.
Hayden, M. S., and Ghosh, S. (2004). Jelzés az NF-kappaB-nak. Gének Dev. 18, 2195–2224.
PubMed Abstract | Google Scholar
Wang, X. and Chen, X. J. (2015)., A mitokondriumok által közvetített proteosztatikus stresszt és sejthalált elnyomó citoszolikus hálózat. Természet 524, 481-484. doi: 10.1038 / nature14859
P > PubMed Abstract / CrossRef teljes szöveg / Google Scholar