a rák olyan betegségek komplex és heterogén csoportjára utal, amelyeket a sejtek ellenőrizetlen és rendezetlen proliferációja jellemez, amelyek gyakran képesek más szövetek behatolására. A rák általában szomatikus sejtekből származik, amelyek egy sor genetikai mutáció következtében elkerülik a szöveti homeosztázist szabályozó mechanizmusokat, mint például a sejt-sejt kapcsolat gátlása, differenciálódási jelek és sejthalál indukció., A tumortranszformációért felelős mutációk a gének két fő csoportjára, az úgynevezett proto-onkogénekre (a sejtciklus stimulátoraira) és a tumorszuppresszorokra (a sejtciklus progressziójának represszoraira) vonatkoznak. Ezek a funkcionális változások egyetlen nukleotidmutáció következtében fordulhatnak elő, de a genetikai anyag nagyobb módosításai, például Beillesztések, törlések, duplikációk vagy kromoszóma fragmentumok transzlokációi is okozhatják őket. Ezek a rendellenességek a rákos sejtekben tumor biomarkerekként használhatók., A génmásolatok számának vagy a génmódosítások változásainak számszerűsítése kritikus fontosságú a tumorbiológia megértéséhez, ezért fontos a molekuláris citogenetikai profilalkotáson alapuló genetikai vizsgálatok fontossága.
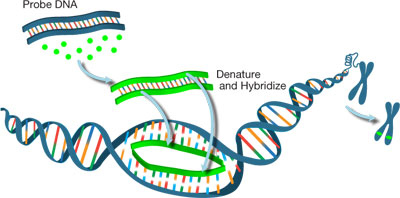
1.ábra: a DNS-szonda címkézése a halak elemzéséhez.
mi a hal ?
A fluoreszcencia in situ hibridizáció (hal) egy citogenetikai technika, amelyet a nukleotidszekvenciák (DNS vagy RNS) kimutatására és lokalizálására használnak a szövetekben vagy sejtekben., A halak felhasználhatók az emberi sejtek genetikai anyagának “feltérképezésére”, információt szolgáltatva a specifikus gének vagy kromoszóma részek helyéről, hosszáról és példányszámáról. Szükség van egy fluoreszcens címkével ellátott szonda szintézisére, amely egy fluoreszcens reporter molekulához kötött nukleinsav-szekvencia, amely ezután egy adott célszekvenciához kötődik (hibridizálódik). A HALSZONDÁKAT különböző módszerekkel (pl. nick fordítás, véletlenszerű alapozás) lehet címkézni, kezdve a különböző nukleinsav-bemenetektől, például genomikus DNS/RNS, bakteriális mesterséges kromoszómák (BACs) vagy kozmidek.,
A HALFOLYAMAT első lépése a metafázis kromoszóma-terjedések vagy a cél DNS-t tartalmazó interfázissejtek immobilizálása egy üvegcsúszdán. Ezután mind a DNS-mintát, mind a HALSZONDÁT hő denaturálja. Amikor a szonda érintkezik a cél genetikai anyaggal, kifejezetten kötődik a kromoszómán lévő kiegészítő szekvenciájához. A szondák és azok szekvenciacéljai között képződött hibridek ezután fluoreszkáló mikroszkóppal láthatóvá válnak (1.ábra)., Általában kétféle HAL szonda lehet megkülönböztetni: a kromoszóma számlálás szondák (CEPs vagy CENs) célzás a pericentromeric régiók kromoszóma használt felsorolni kromoszómák; valamint a locus-specifikus mutatók (LSI) kifejezetten felismerve gének az érdeklődés.
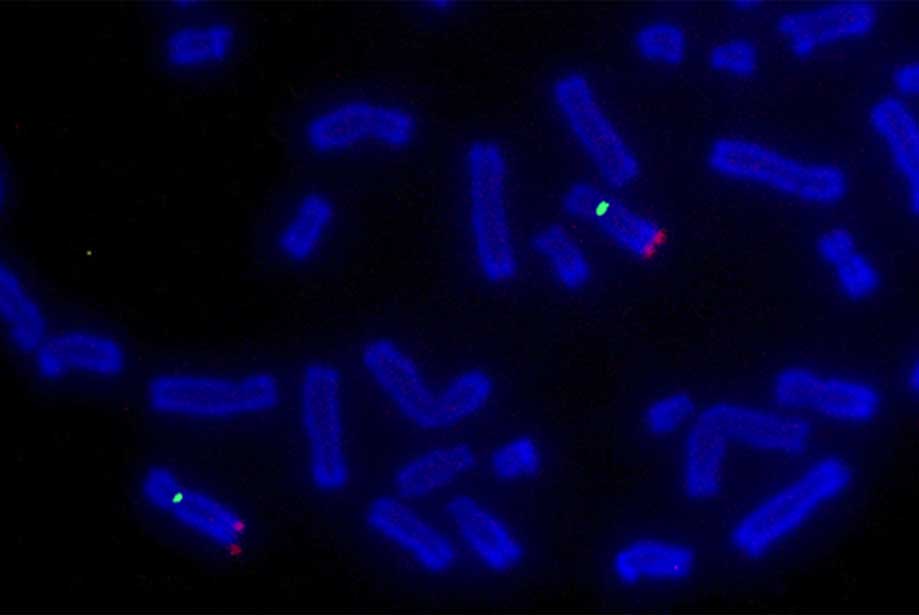
2. Ábra: Példa a HAL eredmények: Nick Fordítás DNS-Címke Rendszer 2.0 használt címke BAC DNS-szonda TP53 a SEEBRIGHT® Narancs 552 dUTP de BAC DNS-szonda Centromere 17 SEEBRIGHT® Zöld 496 dUTP., A felcímkézett szondákat metafázis-terjedésekre hibridizálták. (Institut Universitaire du Cancer Toulouse Oncopole)
a halaknak számos előnye van más klasszikus citogenetikai technikákkal szemben, mint például a G-sávos kariotipizálás. Először is, nagyobb felbontású (20-150kb vs 5MB). Ezenkívül a hal alkalmazható mind a metafázis, mind az interfázis kromoszómákra, ami azt jelenti, hogy a sejteket nem kell több napig tenyészteni, mielőtt a kromoszómák elemzésre készülhetnek., Ez azt is jelenti, hogy a hal alkalmas különféle mintatípusok, köztük a szilárd daganatok és a formalin-fix paraffin-beágyazott (FFPE) szövetek elemzésére. Ezenkívül a halszondákat különböző fluorofórokkal lehet címkézni, lehetővé téve több hely egyidejű ellenőrzését.
FISH-ing kromoszóma aberrációk a rákban
sokoldalúságának köszönhetően a hal felhasználható mind a szilárd daganatok (például emlőrák, nem kissejtes tüdőrák, colorectalis rák), mind a vér hematológiai vagy rákjának (például leukémia, limfómák, myeloma multiplex) citogenetikai elemzésére., A genetikai rendellenességek kimutatása nemcsak a rák számára hasznos, hanem a genetikai hajlam és a betegségspecifikus információk elemzésének, valamint a kemoterápiás kimenetel előrejelzésének eszközeként is.
hal a tüdőrákban
A tüdőrák a leggyakrabban diagnosztizált és a rák okozta halálesetek vezető oka. Különösen a nem kissejtes tüdőrák (NSCLC) az összes tüdőrák ~80-85% – át teszi ki. Az EGFR és az ALK gének szomatikus mutációi gyakran kapcsolódnak az NSCLC-hez., EGFR (Epidermális Növekedési Faktor Receptor) egy osztály a tirozin kináz receptor, akinek tevékenysége a liberalizált különböző típusú epithelialis daganatok (beleértve a tüdőrák), mivel ezek fontos szerepet játszanak a rákos sejt proliferációt, angiogenezis, valamint az áttétek. Ezért az EGFR funkció zavarására szolgáló különböző stratégiákat általában kihasználják a betegek terápiájában. Ezen receptorok tirozin-kináz aktivitásának gátlóit (pl. erlotinib, gefitinib) széles körben alkalmazzák a klinikai NSCLC kezelésekben., Sajnos az EGFR diszfunkció alapjául szolgáló genetikai mutációk sokfélesége miatt egyes betegek érzéketlenek az ilyen típusú kezelésre. A betegek különböző csoportjait valóban meg lehet különböztetni az EGFR által végzett változás típusa alapján, például génerősítés, törlés vagy egyetlen nukleotid szubsztitúciók, amelyek különböző módon változtathatják meg aktivitását (azaz nem a tirozin-kináz doménen keresztül). Ennek eredményeként a hal által meghatározott EGFR példányszám az egyik biomarkerek, amelyeket a helyes terápia kiválasztására használnak.,
a halakat általában az ALK gén inverzióinak vagy transzlokációinak kimutatására használják. Az ALK gén a 2. kromoszóma (2p23) rövid karján található, és a transzmembrán tirozin-kináz receptor kódol. Az ALK-t nem szabad kifejezni a felnőtt tüdőben. Kóros körülmények között azonban az ALK gén megtöri és összeolvasztja a 3 “(a tirozin-kináz domént tartalmazó) génjét más gének 5 ” – jével. Ez az esemény az ALK downstream jelátviteli utak ellenőrizetlen aktiválásához vezethet. A leggyakoribb fúzió az EML4-rel történik, mivel a 2. kromoszóma rövid karján inverzió következik be.,
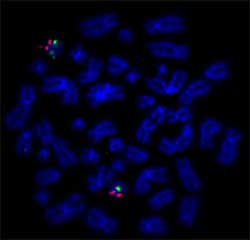
a hal az FDA által jóváhagyott módszer az ALK gén inverzióinak vagy transzlokációinak kimutatására. Jellemzően a gén 3′ és 5′ régióját célzó szondákat különböző fluorofórokkal jelölik: negatív magokban a színek egymáshoz közel (gyakran átfedő) jelennek meg, míg a rákos sejtekben a jelek a kromoszóma átrendeződése következtében szétoszlanak (4.ábra).

3.ábra: a hal által kimutatott ALK gén transzlokáció reprezentatív nézete., A gén 5′ és 3 ‘ régióját zöld, illetve vörös fluoreszcenciával vizualizáljuk. A. vad típusú mag. B. rákos sejtmag, amely megmutatja a jellegzetes szondákat. C. rákos sejtmag, amely megmutatja a jellegzetes szondákat. Egy harmadik szonda segítségével meghatározható a ténylegesen előforduló kromoszóma-átrendeződés.
a potenciális ALK partnert célzó harmadik szonda tovább erősítheti és meghatározhatja a betegben előforduló kromoszóma átrendeződést (4c.ábra)., Az ALK hiperaktivációhoz vezető mutációkat hordozó tüdőrákok ALK-gátlókkal, például Krizotinibbel kezelhetők.
hal emlőrákban
ez a leggyakoribb rosszindulatú daganat a nőknél, és a rák okozta halálozás második fő oka világszerte. A mellrákot gyakran a receptorállapot rendellenességei jellemzik, ami a sejtproliferációért és a túlélésért felelős sejttranszdukciós útvonalak felszabályozásához vezet. Különösen az emlőrákos daganatok körülbelül 20-30% – A ismert, hogy túlexpresszálja a HER2/Neu-t, az EGFR család tagja., Ezekben az esetekben gyakori kezelés a trasztuzumab, egy humanizált monoklonális antitest, amelyet az FDA 1998-ban jóváhagyott az emlőrák kezelésére. Pontos molekuláris mechanizmusa még nem tisztázott, de ez az antitest valószínűleg megakadályozza a HER2 aktiválódását az extracelluláris doménhez való kötődéssel. Ezenkívül úgy tűnik, hogy az antitest-függő sejt citotoxicitást (ADCC) stimuláló tumorsejt-lízist indukál. A HER2 ellen megfelelő szondát használó halak felhasználhatók a gén további másolatainak azonosítására, ami azt jelzi, hogy nagyobb valószínűséggel reagál a trasztuzumab kezelésre.,
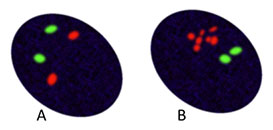
4.ábra: a lehetséges emlőkarcinóma-sejtek reprezentatív nézete. HER2 jel képviseli piros; centromere 17 szonda (zöld) lehet használni, hogy felsorolja kromoszóma száma. A. HER2-nem erősített mellrák: a HER2 gén két centromere 17 és két példánya a várakozásoknak megfelelően. B. HER2-amplifikált mellrák a HER2 többszörös kimutatása.
hal hólyagrák esetén
ez az ötödik leggyakoribb humán malignitás és a második leggyakrabban diagnosztizált urogenitális daganat a prosztatarák után., Ez egy poligén betegség, ami azt jelenti, hogy több genetikai anomáliához kapcsolódik, mint például az FGFR3, az RB1, a HRAS, a TP53 vagy a TSC1 gének mutációi. Az iniciációs esemény azonban valószínűleg mutáció a 9p21 régióban, amely tartalmazza a p16/CDKN2A gént. Ezenkívül a hólyagrák sejtjeit a kromoszóma instabilitás (CIN) fokozott mértéke jellemzi. A diszfunkcionális kromoszóma duplikáció vagy szegregáció a mitózis során DNS átrendeződést és transzlokációt, egész kromoszómák (aneuploidia) vagy kromoszóma fragmensek nyereségét vagy elvesztését okozza., A genetikai anyag ebből eredő kiegyensúlyozatlansága minden sejtciklus után romlik. Az ebből következő genomikai minták a tumorfejlődés különböző szakaszaihoz kapcsolódhatnak, az invazív formák pedig a citogenetikai változások nagyobb számát mutatják.
a húgyhólyagrák sejtjeiben található numerikus és szerkezeti kromoszóma-változások tumormarkerekként használhatók.
konkrétan gyakori gyakorlat a 3., 7. és 17. kromoszómák másolási számának egyidejű kimutatása, valamint a 9P21 régió (P16-ot tartalmazó) hal általi törlése négy különálló szondával., Ez a módszer hasznos információt nyújt a rák progressziójáról és a kiújulásról.
hal krónikus lymphocytás leukémia (CLL)
hematológiai malignitások elemzése az egyik tipikus példa a halak előnyeire a változó kariotípusú és alacsony mitotikus aktivitással jellemzett minták elemzéséhez. A CLL a leggyakoribb leukémia felnőtteknél. Nem társult specifikus ismétlődő genetikai változással., Ehelyett, hasonlóan a hólyagrák, egy panel különböző mutációk összefüggésbe hozták a különböző súlyossága a betegség, és használják prediktív mutatók a beteg klinikai lefolyása. Ebben az esetben a halpanelek gyakran tartalmaznak szondákat a 12-es triszómia, valamint a 11Q, 13Q és 17p törlések kimutatására., Törlés 11q, amely a legtöbb esetben vonatkozik a gén ATM, megtalálható a betegek mutatja, egy gyors progresszió a rák; triszómia 12 társul előrehaladott szakaszában a betegség, az ellenállás, a kemoterápia pedig rövidebb túlélési idő; törlés 13q a leggyakrabban talált, s általában társul egy kedvezőbb prognózis; törlés 17p gyakran tartalmaz törlés a TP53 gén felel meg, előrehaladott stádiumban a daganat, a szegények túlélési arány.
Az Enzo Life Sciences globális vezető szerepet tölt be a DNS-és RNS-címkézési technológiák terén., Kínálunk egy sor termék a genomika és a rákkutatás igényeinek. A címkézett DNS előállításának egyszerű és hatékony módja érdekében kérjük, tekintse meg Nick translation DNS címkéző készletünket, valamint a SEEBRIGHT® fluoreszkáló festék-dutp és Allylamine-dUTP listánkat. Nem biztos abban, hogy biotint vagy digoxigenint használ-e az ISH szonda címkézéséhez? Ott segíthetünk! Ne felejtse el ellenőrizni Enzo spektrumnézegetőjét a közös színezékek gerjesztési és emissziós hullámhossz-profiljai, valamint a többi fluoreszcencia sejt alapú vizsgálat., Ha már itt tartunk, nézze meg a TechNote-t a halak, az aCGH és az NGS előnyeiről és hátrányairól, valamint arról, hogyan kell allylamine-dUTP-ot használni a hal DNS-szonda címkézéséhez. Minden kérdés és aggodalom tekintetében bármely termékünk, a technikai támogató csapat van itt, hogy segítse.