Bevezetés
az emberi genom projekt befejezése fontos mérföldkő volt az orvosi ismeretek számára, biztosítva az egyes egyének egyedi jellemzőinek megértéséhez szükséges információkat.1 ennek a tudásnak az lenne a logikus következménye, hogy egyedi genetikai információik alapján minden betegre specifikus diagnosztikai teszteket és kezeléseket alkalmazhatunk. Az orvosi ellátás új formáját személyre szabott gyógyszernek nevezik.,2 az emberi genom megismeréséhez vezető nagy fejlődés ellenére azonban a diagnosztikai és személyre szabott kezelésekre való átállás a vártnál kisebb volt. Jelenleg két fő kezdeményezéssel, a systems biology3-mal és a farmakogenetikával foglalkoznak ebben az irányban.,4 A végső cél az, hogy ezek a kezdeményezések, hogy dolgozzon ki egy orvosi gyakorlatban szabott jellemzők egyes, hogy képes megjósolni a kezdete, vagy egy adott betegség, lehetővé teszi a megfelelő megelőzési stratégiák létre kell hozni, végül lehetővé teszi a beteget, hogy részt vegyen a döntéshozatalban. Ezt P4 gyógyszernek hívták.5
a cisztás fibrózis (CF) továbbra is a leggyakoribb és leghalálosabb genetikai betegség a kaukázusiak körében., A régiótól és etnikai hovatartozástól függően 2500-6000 újszülöttből 1-nél, az egészséges hordozók arányában pedig 1:20 és 37,6 között változik Spanyolországban, az újszülöttkori szűrőprogramok fokozatos bevezetésének köszönhetően a különböző közösségekben a CF előfordulása alacsonyabb, mint 2009-ben korábban becsülték, azaz 1/4430 élveszületés Galíciában, 1/4339 Kasztília-Leonban, 1/5376 Murciában, Katalóniában 1/5840, a Baleár-szigeteken 1/6602.7 a becslések szerint világszerte 70000 CF beteg van.,8 a betegséget a szabályozó fehérjét kódoló gén mutációi okozzák cisztás fibrózis transzmembrán vezetőképesség szabályozó (CFTR), az adenozin-trifoszfát felszabadulásában részt vevő klorid-csatorna, valamint más ionszállító csatornák szabályozása. Ezt a fehérjét a légzőszervi hámsejtekben, a hasnyálmirigyben, az epeutakban, a verejtékmirigyekben és az urogenitális rendszerben fejezik ki., Változása az ionszállítás rendellenességéhez vezet, így a betegek vastag, ragacsos nyálkahártyát termelnek, amely eltömíti a szerv csatornáit, ahol található, így a változás multiszisztémikus hatásokat mutat, amelyek meghatározzák a CF klinikai megnyilvánulásainak széles skáláját. Annak ellenére, hogy jelentős előrelépés a kezelés CF, amelyek eredményeként a hosszabb túlélés (jelen medián becsült 37.5 év),9 még hosszú utat kell megtennie annak érdekében, hogy a betegek CF van egy mennyiség, életminőség hasonló témákról anélkül, hogy a betegség., Ebben az összefüggésben új kezelésekre van szükség a morbiditás csökkentése és a túlélés növelése érdekében.
a CF egy olyan betegség példája, amely jól helyezkedik el, hogy kihasználja a személyre szabott gyógyszert. Egyrészt monogén betegség, amelyet egy adott gén mutációi okoznak. Az entitás patofiziológiája jól jellemezhető, a terápiás célok egyértelműek. Ezenkívül a betegség diagnosztizálása genetikai vizsgálatot igényel a betegség típusának azonosításához, így a pontos genetikai hibát minden esetben meghatározzák.,10
jelenleg két nagyon különböző megközelítés irányul az alapvető hiba kijavítására: génterápia, amelynek célja a genetikai változás kijavítása, valamint molekula terápia, amelynek célja a funkcionális hiba fehérje szinten történő kijavítása. A génterápia középpontjában a normál génmásolatok bevezetése a CF betegek légutaiban. Ez magában foglalja egy rekombináns vírusvektor behelyezését, amelynek DNS-ét kivonták és felváltották az új terápiás DNS. A vírusvektor járműként szolgál az új DNS behelyezésére a célsejtbe., Különböző típusú vírusokat, például adenovírust vagy lentivírust használtak eddig. Ezenkívül kifejlesztettek nem vírusrészecskéket, például a DNS beillesztésére képes nanorészecskéket is.11 az eddigi eredmények azonban rosszak voltak, mivel a bevezetett gén expressziójának időtartama mindkét típusú vektor esetében rövid volt.12 Az Egyesült Királyság génterápiás konzorciuma egy fázis II klinikai vizsgálatot dolgoz ki egy optimalizált plazmid/liposzómális DNS vektor klinikai hatékonyságának értékelésére.13 a felvételi célérték 130 beteg, és az eredmények 2014-ben várhatóak (NCT01621867).,14
másrészt a CFTR fehérje működésének helyreállítására irányuló terápia sikeresebb volt. Az utóbbi években az eredmények olyan gyógyszereken kezdődnek, amelyek közvetlenül a CFTR fehérjére hatnak. Valójában 2012 januárjában az Egyesült Államokban forgalmazták az első gyógyszert a gly551asp mutációs hibák kijavítására. A következő szakaszokban áttekintjük a személyre szabott gyógyszer CF-re történő előrehaladásáról rendelkezésre álló információkat, valamint a rendelkezésre álló kezeléseket, amelyek célja a betegséget okozó hiba fehérje szinten történő kijavítása., Ebben a felülvizsgálatban a humán genom variációs Társaság15 által kifejlesztett CFTR génmutációk leírására használt nómenklatúrát kell használni.
mutációk és Protein defektus
a CF egy autoszomális recesszív örökletes betegség, ezért a mutációnak jelen kell lennie a CFTR gén mindkét példányában, amelyet érinteni kell. Eddig több mint 1900 CFTR génmutációt azonosítottak a betegséggel kapcsolatban a kódolási szekvenciában, a messenger RNS-ben vagy más elemekben. A CFTR gén mutációi megtekinthetők a cisztás fibrózis mutációs adatbázisában.,16 az első leírt mutáció, a leggyakoribb világszerte a Phe508del, de vannak más specifikus mutációk is, amelyek különböző etnikai csoportok között eltérő gyakorisággal fordulnak elő. Spanyolországban a Phe508del mutáció átlagos gyakorisága az összes vizsgált kromoszóma 50-60% – a között van, a második leggyakoribb a Gly542X, 4% -8% – kal, majd az Asn1303Lys az esetek 2% -4% – ában. Az eddig leírt mutációkat a betegséget okozó mechanizmus szerint hat típusba vagy osztályba sorolják.17 az ilyen típusú mutációkat az ábra foglalja össze. 1., Az I. osztályú mutációk idő előtti stop kodonhoz vezetnek a messenger RNS-ben, ami megakadályozza a teljes fehérje fordítását. Így a termelt fehérje rövid és nem működik. A II. osztályú mutációk strukturálisan abnormális és rosszul bekötött fehérjét kódolnak, amelyet az endoplazmatikus retikulum eltávolít, mielőtt elérné a sejtfelületet. A CF leggyakoribb mutációja, a Phe508del ebbe a csoportba tartozik. A III-VI. osztályba tartozó mutációk esetén a fehérjék elérik a sejtfelületet, de nem működnek megfelelően. A III. osztályú mutációk csökkent csatorna aktiválást okoznak, így a csatornák zárva maradnak., A IV. osztályú mutációk az ionvezetőképesség csökkenését okozzák a csatornán keresztül. Az V. osztályú mutációk kisebb fehérjéket kódolnak, ami csökkentett mennyiségű CFTR-t eredményez a sejtfelszínben, így egy bizonyos funkció bekövetkezik, de csökkentett szinten. Végül a VI. osztályú mutációk a fehérje instabilitása miatt rövidített felezési időt eredményeznek, és károsíthatják a szomszédos CFTR csatornák szabályozását a sejtfelszínen.
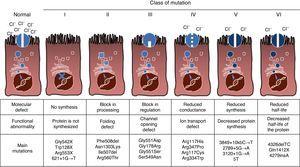
a cisztás fibrózis mutációinak típusai.
CFTR modulátorok
három fő osztályt azonosítottak a CFTR fehérje javítására szolgáló gyógyszerek kifejlesztésében.11 az első csoport a korai stop kodon szuppresszorok (I. osztályú mutációk). Ezek a gyógyszerek megakadályozzák a korai stop kodon azonosítását, így a fehérjeszintézis a befejezésig folytatódhat. A második csoport a CFTR korrektorok. Ezeket a vegyületeket úgy tervezték, hogy kijavítsák a hajtogatott fehérje (II. osztályú mutációk) sejtmembránba történő szállításának hibáit, ahol szinte normálisan képes működni., A harmadik csoport az úgynevezett CFTR potenciátorokból áll. Ezek olyan gyógyszerek, amelyek célja a CFTR fehérje célpontja a sejt felületén annak működésének javítása érdekében. Így ezek a potenciátorok hatással lehetnek a III., IV., V. és VI. Jelenleg számos, ezeket a különböző mechanizmusokat alkalmazó molekulát vizsgálnak, amelyek közül az egyik már elérte a piacot: az Ivakaftor (VX-770) egy CFTR potenciátor, amelyet 2012 januárjában hagytak jóvá az Egyesült Államokban a 6 évesnél idősebb, GLY551ASP mutációval rendelkező CF betegek kezelésére.,
I. osztályú mutációs kezelések
a CF esetek körülbelül 10% – át I. osztályú mutációk okozzák. Az első ebbe az osztályba használt gyógyszerek aminoglikozidok voltak. Néhány évvel ezelőtt arról számoltak be, hogy a gentamicin képes elfedni a CFTR fehérje szintézisét megakadályozó korai stop kodont. Ezt egy olyan aminosav beillesztésével érik el, amely lehetővé teszi a riboszóma számára, hogy folytassa a gén olvasását, teljes hosszúságú fehérjét előállítva. A preklinikai vizsgálatok kimutatták, hogy a fehérje egérmodellben szintetizálható, és a fehérje funkció 35% – át in vitro nyerték vissza.,18,19 a gentamicin intravénás beadásának hatását két, különböző I. osztályú mutációjú CF-betegekkel végzett vizsgálatban értékelték. Az egyiket az USA-ban öt beteg, 20, a másik pedig 18 beteg részvételével végezték Franciaországban.21 bár a válasz pozitív volt, az eredmények széles körben változtak, így az előny nem volt univerzális. Ezenkívül az aminoglikozidokkal kapcsolatos toxicitási problémák kedvezőtlen profilt eredményeztek.
szintetikus alternatíva az ataluren (PTC124; PTC Therapeutics, South Plainfield, NJ, USA)., Ez egy olyan molekula, amely lehetővé teszi a riboszómák számára a genetikai információk olvasását, miközben “kihagyja” a korai stop kodont, funkcionális CFTR fehérjét termel.22 az ataluren farmakokinetikáját állatkísérletekben és II. fázisú vizsgálatokban igazolták. Két kis előzetes vizsgálatban,23, 24 az orális atalurennel kezelt CF-betegek egy csoportja javította a betegség elektrofiziológiai rendellenességeit, az orrban lévő sejtek számának növekedésével, amely a fehérjét expresszálta a felületükön., Ezt követően egy másik, 19 betegből álló kis vizsgálatban 8 óránként orálisan adott ataluren különböző dózisait értékelték, javítva a CFTR-aktivitást és a klinikai paramétereket, valamint jó biztonságossági profilt.25 a 2012-es észak-amerikai cisztás fibrózis konferencián jelentették az ataluren fázis III klinikai vizsgálatának hivatalosan még nem publikált eredményeit. Összesen 238, 6 évesnél idősebb beteget randomizáltak az ataluren 10, 10, 20mg/ttkg vagy a placebo 8H-os kezelésére 48 héten keresztül., A 48 hetes kezelés után nem volt szignifikáns különbség a FEV1-ben az ataluren-ben a placebóval szemben (-2, 5% ataluren vs -5, 5% placebo, P=ns). Amikor rétegzett által krónikus nebulized antibiotikum-használat, volt egy 6,7% – os változást jelent, a változás 48 hét után javára ataluren a betegek nem tobramycin, amíg nem volt különbség a változás a FEV1 azokban a fogadó nebulized tobramycin. Valami hasonló történt az exacerbációk százalékával, ahol a két csoport közötti különbség jelentős volt., Rétegződés esetén az ataluren-csoportban nem porlasztott tobramicinnel kezelt betegek a placebo-csoporthoz képest 43% – kal csökkentették az exacerbációk százalékos csökkenését. Az orrpotenciál-különbség és a verejtékklorid-vizsgálatok nem mutattak különbséget csoportok között, függetlenül a porlasztott antibiotikumok alkalmazásától. A szerzők arra a következtetésre jutott, hogy az előnyök nagyobbak voltak, nem részesülő betegek krónikus antibiotikum terápia nebulized aminoglikozid, spekuláció, hogy tobramycin, valamint ataluren kapcsolatba a ribosomal szinten, termelő ellentét, amikor egyszerre használni.,26
II. osztályú mutációs kezelések
II. osztályú mutációk, amelyek a betegség leggyakoribb mutációja (Phe508del), nagyszámú CF-betegben vannak jelen, így elsődleges célpontjuk a CF-kutatás. Különböző molekulákat vizsgáltak, amelyek nagy részét a Vertex Pharmaceuticals Inc.fejlesztette ki. Az első korrektorvegyület, a lumakaftor (VX-809) Jó in vitro hatékonyságot mutatott, javítva a klorid szállítását 14% – ban.,27 Az eredmények azonban kissé kiábrándítóak voltak a betegeknél, mivel az izzadság kloridkoncentrációjának javulása nagyon kicsi volt (7mmol/l), és az orrpotenciálban nem volt változás.28
a CFTR potenciátor ivakaftor (VX-770), a III.osztályú mutációk gyógyszerének hatásait (lásd az alábbi leírást), szintén vizsgálták olyan betegeknél, akik homozigóta voltak a Phe508del esetében. A DISCOVER vizsgálat eredményei azt mutatják, hogy az ivakaftor nem jár a FEV1, az életminőség vagy az exacerbációk számának jelentős javulásával a placebóhoz képest.,29
mivel a lumakaftor elősegítheti a Phe508del-CFTR sejtfelszínre jutását, és az ivakaftor növeli a nyitási időt és a kloridvezetést az epiteliális sejten keresztül, a mögöttes Phe508del-hiba javulása mindkét molekula kombinációjával lehetséges. A kombinált ivakaftor és lumakaftor in vitro vizsgálata a phe508del mutációval rendelkező légzőszervi epitheliákban azt mutatta, hogy a lumakaftor önmagában 15% – kal növeli a CFTR-klorid transzportját, és ivakaftor alkalmazása esetén a transzport közel 30% – ra nő., Ezt a gyógyszerkombinációt egy fázis II vizsgálatban tanulmányozták Phe508del mutációban szenvedő betegeknél. A teljes eredményeket még nem tették közzé, de a kezdeti adatok arra utalnak, hogy a homozigóta Phe508del-ben jótékony hatással van a tüdőfunkcióra, de heterozigozitásban nem.30 két, 12 éves vagy idősebb homozigóta betegeken végzett klinikai vizsgálatot dolgoznak ki a Phe508del mutációra vonatkozóan a kombinált ivakaftor és lumakaftor értékelésére; ezek a TRAFFIC (NCT01807923)31 és a TRANSPORT (NCT01807949)32 vizsgálatok. Az eredmények lehetővé teszik, hogy a CF-populáció körülbelül fele CFTR moduláló terápiát kapjon., Azonban vizsgálatokra van szükség a kombinációs terápia hatásának értékeléséhez phe508del heterozigóta egyénekben.
egy másik alternatíva a VX-661 korrektor vegyület, és a vizsgálatok jelenleg is folynak. Hatékonyságát önmagában és ivakaftorral (VX-770) kombinálva tesztelik, és az eredmények hamarosan elérhetők lesznek (NCT01531673).33
III. osztályú mutációs kezelések
az Ivakaftor (VX-770) egy CFTR potenciátor, amely modulálja az abnormális fehérje működését.,34 ezt a molekulát eredetileg úgy tervezték, hogy fokozza a CFTR funkciót a légzőszervi hámsejtek kultúráiban, amelyek egyetlen gly551asp mutációt hordoznak.34 Ez az első gyógyszer, amelyet az USA-ban és Európában engedélyeztek a CF kezelésére a gly551asp mutációt hordozó betegeknél. Miután in vitro kimutatták az ivakaftor kapacitását a sejtmembránon keresztül történő klorid-szállítás javítására, az első fázis II vizsgálatokat 39 beteggel végezték.35 ebben a vizsgálatban a CFTR fehérjefunkció a kezelés megkezdése után három nappal javult, elérve a klorid koncentrációját a verejtékben a normál szintig., Ezekkel az eredményekkel további két klinikai vizsgálat következett: a STRAKE vizsgálat 144, 12 éves vagy annál idősebb betegen36, valamint az ENVISION vizsgálat 52, 6 és 11 év közötti gyermek bevonásával.37 Mindkét vizsgálatban a betegek legalább egy Gly551Asp mutáció, valamint FEV1 között 40% 105%, hogy kezdetben követte egy 14 napos időszakra, majd randomizálták, hogy 150mg a szóbeli ivacaftor vagy placebo-kétszer egy nap időtartamra 48 hét., A 48 hetes kezelés befejezése után a betegek lehetőséget kaptak arra, hogy folytassák a longitudinális nyílt vizsgálatot,a resist vizsgálatot (NCT0117012), 38-at 96 héten keresztül.
az IVAKAFTOR-csoportban a betegek a kezelés 15.napjától kezdődően 10, 6%-kal javultak a FEV1-ben (elsődleges végpont), ami a 48 hetes vizsgálat során fennmaradt. Ezenkívül a verejték kloridkoncentrációjának csökkenését figyelték meg (átlag: -48,7 mmol/l), jobb életminőséggel, 55% – os exacerbáció-csökkenéssel és 2,7 kg-os súlygyarapodással.,
az ENVISION vizsgálat eredményei nagyrészt egybeesnek a serdülőknél és felnőtteknél végzett vizsgálat eredményeivel, azzal a különbséggel, hogy az életminőség nem érte el a statisztikai különbséget. A terápiás csoportban mind a terápiás, mind az elképzelési vizsgálatokban gyakrabban megfigyelt mellékhatások a felső légúti fertőzések, az orrdugulás, a torokfájás, a szédülés és a bőrkiütés voltak., A tartós vizsgálat első 12 hetét követő előzetes eredmények azt mutatják, hogy az ivakaftorral kezelt betegek körében a tüdőfunkció (FEV1), a légzőszervi tünetek és a súlygyarapodás javulása ebben az időszakban is fennmarad. Ezen túlmenően azon betegek alcsoportja, akik a vizsgálat megkezdésekor PLACEBÓRÓL ivakaftorra váltottak, továbbra is 15 napon belül 10,8% – kal, 12 héten belül pedig 13% – kal javultak a FEV1-ben, az exacerbációk csökkenésével együtt.,39
annak ellenére, hogy az ivakaftor jó eredményeket ért el a gly551asp mutáció kezelésében 6 évesnél idősebb gyermekeknél és 48 hetes felnőtteknél, néhány kérdés még megoldandó. Először is, a gyógyszert nem vizsgálták 6 év alatti gyermekeknél. Ésszerűnek tűnik azonban a hiba kijavítása, mielőtt visszafordíthatatlan károsodás következik be, figyelembe véve, hogy a tüdő bevonása hat éves kor előtt kezdődik. Ebben a korosztályban jelenleg folyamatban van egy próba (NCT01705145).40 másodszor, egy másik alternatíva az lenne, ha megpróbálnánk más III.osztályú mutációkat is., Ebben a tekintetben kilenc másik mutációval végzett in vitro vizsgálatok nagyon hasonló eredményeket mutattak,41 ezért indokolt hasonló eredményeket várni a betegeknél. Folyamatban van egy III. fázisú klinikai vizsgálat más III. osztályú mutációkkal (KONTINUE és KONNECTION vizsgálatok; NCT01614470) rendelkező, 6 évesnél idősebb betegeknél.42,43 harmadszor, bár a többi mutációs osztály (IV-VI) esetében nem áll rendelkezésre kezelés, a CFTR potenciátorok ezekben az esetekben egyaránt előnyösek lehetnek., E tekintetben klinikai vizsgálatot folytatnak az Ivakaftor hatásosságának értékelésére az Arg117His IV. osztályú mutációban (KONDUCT vizsgálat; NCT01614457).Végül 44 Az ivakaftor hatásosságát és hosszú távú biztonságosságát 48 héten túl még nem állapították meg. A G551D Observational Study (GOAL; NCT01521338)45 egy megfigyelési vizsgálat 6 évesnél idősebb ivakaftor-kezelésben részesülő betegeket követően., Célja, hogy beszámolási a biztonságosság a hosszú távú ivacaftor, valamint más eredmények érdekes, hogy tartalmazza a gyulladásos mediátorok, a köpet, mucociliary elszámolása, valamint a gyomor pH-ja. Az eredmények várhatóan 2013 végén.
következtetések
a CF egy olyan betegség példája, amely jól helyezkedik el, hogy kihasználja a személyre szabott gyógyszert. Jelenleg két nagyon különböző megközelítés célja az alapvető hiba kijavítása: a genetikai változás kijavítását célzó génterápia, valamint a fehérje szintjén a funkcionális hiba kijavítását célzó molekulák terápiája., Ez utóbbi ígéretes eredményeket mutat a fejlesztés különböző molekulái számára, amelyek közül az egyiket (ivakaftor) már forgalomba hozták a GLY551ASP III.osztályú mutációra, kiváló eredményekkel 6 évesnél idősebb gyermekeknél, serdülőknél és felnőtteknél. A végső cél az, hogy minden CF-es beteg számára biztosítsanak korrektor-és potencírozó kezelést, bármilyen mutációjuk legyen is. Amint ezek és más új molekulák eredményei megjelennek, valószínű, hogy egy adott molekulára vagy kombinációra lesz szükség minden beteg számára, a meglévő mutációiktól függően., Mindenesetre a jövő ígéretes, fontos lépéseket tettek egy olyan kezelés megszerzése érdekében, amely hatékonyan befolyásolja a betegség okait.
összeférhetetlenség
A szerzők nem nyilvánítanak összeférhetetlenséget.