A nyomás és a térfogat közötti kapcsolat: Boyle törvénye
a gázra nehezedő nyomás növekedésével a gáz térfogata csökken, mivel a gázrészecskék közelebb kerülnek egymáshoz. Ezzel szemben, mivel a gáz nyomása csökken, a gáz térfogata növekszik, mivel a gázrészecskék most távolabb mozoghatnak egymástól., Az időjárási léggömbök nagyobbak lesznek, amikor a légkörön keresztül az alacsonyabb nyomású régiókba emelkednek, mert a gáz térfogata megnőtt; vagyis a légköri gáz kevesebb nyomást gyakorol a ballon felületére, így a belső gáz addig bővül, amíg a belső és külső nyomás megegyezik.
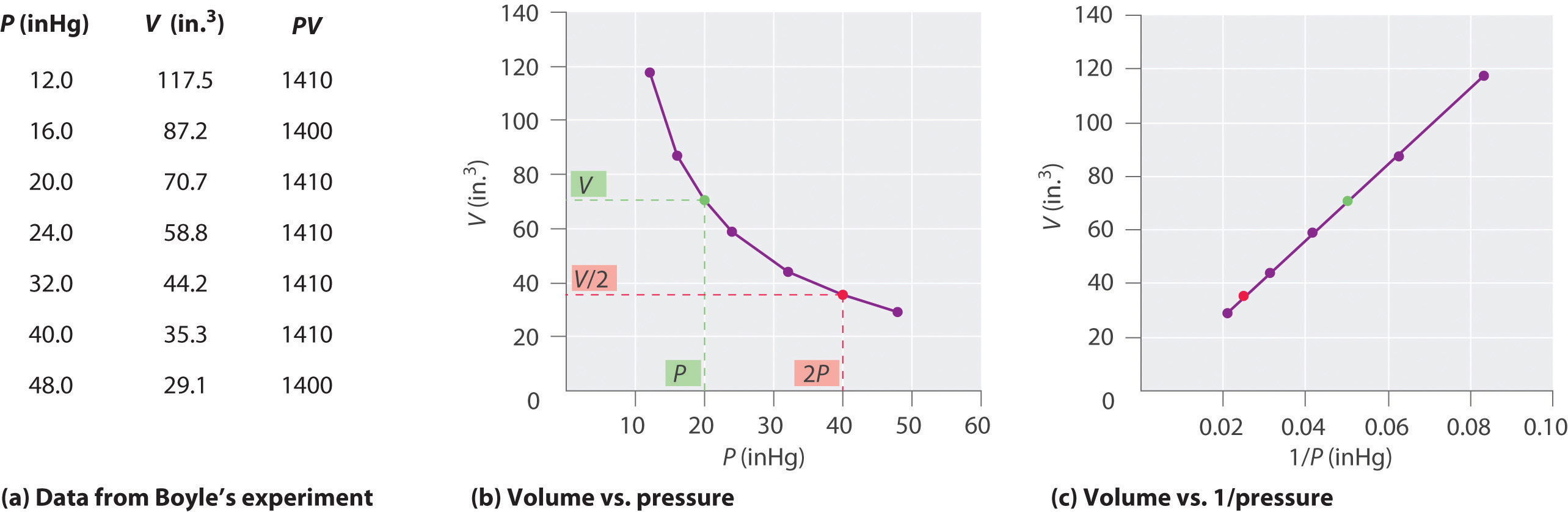
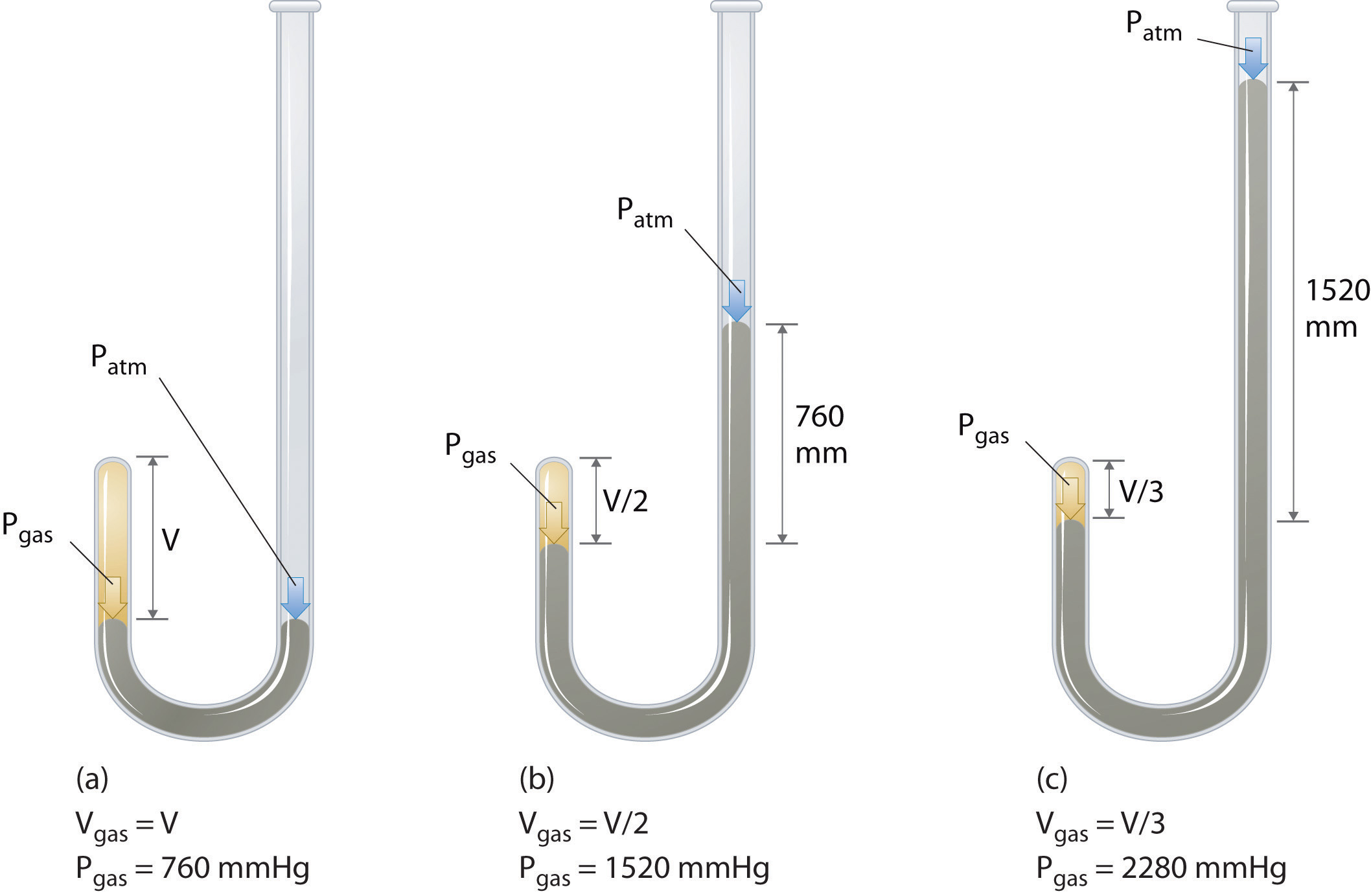
Robert Boyle (1627-1691) ír kémikus néhány legkorábbi kísérletet végzett, amelyek meghatározták a nyomás és a gáz térfogata közötti mennyiségi kapcsolatot. Boyle a \(\PageIndex{1}\) ábrán látható módon J-alakú, részben higanyt tartalmazó csövet használt., Ezekben a kísérletekben kis mennyiségű gáz vagy levegő kerül a higanyoszlop fölé, térfogatát légköri nyomáson és állandó hőmérsékleten mérik. Ezután több higanyt öntünk a nyitott karba, hogy növeljük a gázmintára nehezedő nyomást. A gázra gyakorolt nyomás légköri nyomás, valamint a higanyoszlopok magasságának különbsége, a kapott térfogat mérése. Ezt a folyamatot addig ismételjük, amíg nincs több hely a nyitott karban, vagy a gáz térfogata túl kicsi ahhoz, hogy pontosan mérhető legyen., Az olyan adatok, mint Boyle egyik saját kísérletéből származnak, többféle módon ábrázolhatók (\ábra(\PageIndex{2}\)). A \(V\) versus \(P\) egyszerű parcellája hiperbolának nevezett görbét ad, és a nyomás és a térfogat inverz kapcsolatát tárja fel: mivel a nyomás megduplázódik, a térfogat kettővel csökken. A két mennyiség közötti összefüggést a következőképpen írják le:
\
Elválasztó mindkét oldalán \(O\) ad egy egyenlet bemutató az inverz kapcsolat \(O\), valamint a \(V\):
\
vagy
\
amennyiben a ∝ szimbólum olvassa el “arányos.”A v versus 1/P parcellája tehát egy egyenes vonal, amelynek lejtése megegyezik a 6.2.1 egyenletben és a 6.2.3 egyenletben szereplő állandóval. A 6.2.1 egyenlet mindkét oldalának V-vel való felosztása p helyett hasonló kapcsolatot biztosít a P és az 1/V között., Az állandó numerikus értéke a kísérletben használt gáz mennyiségétől, valamint a kísérletek elvégzésének hőmérsékletétől függ. A nyomás és a térfogat közötti összefüggés a felfedező után Boyle-törvényként ismert, és a következőképpen állapítható meg: állandó hőmérsékleten egy meghatározott mennyiségű gáz térfogata fordítottan arányos a nyomásával.