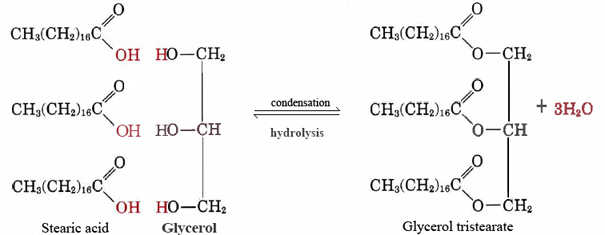
a nem poláris lipid jó példája a semleges zsír glicerin-trisztearát. Az állati zsírnak ez a leggyakoribb formája az energia tárolására, valamint a hőveszteség elleni szigetelésre szolgál. Molekuláris szinten három sztearinsavmolekulából és egy glicerinből áll:
 (1)
(1)
nagyon sok nempoláris lipid készíthető különböző hosszú láncú savak glicerinnel történő kombinálásával., Mivel ezek a savak eredetileg zsírokból származtak, ezeket együttesen zsírsavaknak nevezik.
vegye figyelembe, hogy minden egyes sztearikus vagy más zsírsavmolekula esetében, amely a glicerin egyik —OH csoportjával kombinálódik, egy vízmolekula kerül ki, így a reakció kondenzáció. Kiderül, hogy sok fontos biológiai molekulát kondenzációs reakciókkal állítanak össze, amelyek során a víz ki van adva. A fordított Eq. (1), amelyben a víz reagál egy nagy molekulával, és kisebb darabokra osztja, hidrolízisnek nevezzük., A hidrolízis elvégzésével az élő szervezetek lebonthatják a más fajok által gyártott molekulákat. Az így kapott egyszerű építőelemeket ezután kondenzációs reakciókkal rekombinálhatjuk, hogy új gazdaszervezetüknek megfelelő struktúrákat képezzenek.
az állatokban található glicerin-trisztearáttal ellentétben a növényi zsírok hosszú szénhidrogénláncukban számos kettős kötést tartalmaznak. Ez a poliunsaturáció a szénhidrogénláncokban a forgási akadály és a kettős kötésekhez kapcsolódó 120° – os szög miatt “kinks” – eket vezet be., Következésképpen nehezebb a láncokat egymás mellé igazítani (lásd a \(\PageIndex{1}\) ábrát), és a telítetlen zsírok nem csomagolnak össze olyan könnyen egy kristályrácsban. Az alkánokhoz hasonlóan a lánchossz is meghatározza, hogy a zsír folyékony vagy szilárd, és hol fordul elő az olvadáspont.
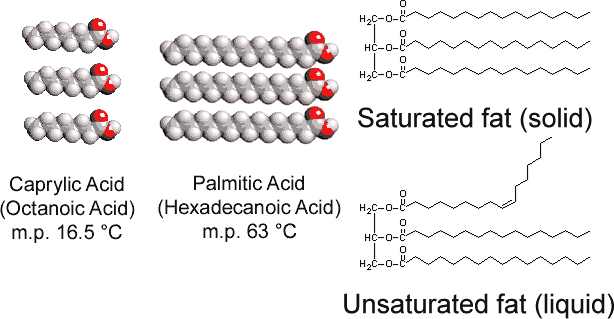
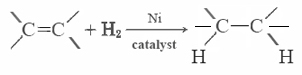
a legtöbb telítetlen zsír (mint például a kukoricaolaj) rendes hőmérsékleten folyadék, míg a telített zsírok (mint a vaj) szilárd anyagok. A növényi olajok hidrogénezéssel szilárd anyagú vegyületekké alakíthatók. Ez a folyamat magában foglalja a H2 katalitikus hozzáadását a kettős kötésekhez:
a zsírok hidrolízise fontos a szappanok gyártásában., Fel lehet gyorsítani egy olyan erős bázis hozzáadásával, mint a NaOH vagy a KOH, ebben az esetben a reakciót szappanosításnak nevezik. Mivel az elszappanosítás megköveteli, hogy a reakciókeverék pH-ja magas legyen, az előállított zsírsav disszociál az anionjához. A glicerin-trisztearát NaOH-val történő szaponizálásakor például nátrium-sztearát, egy viszonylag vízben oldódó anyag és egy közös szappan képződik.
a szappanok zsír és olaj szennyezett felületekről történő tisztításának képessége molekuláik kettős hidrofób-hidrofil szerkezetének eredménye., A sztearát ion például egy hosszú, nem poláris szénhidrogénláncból áll, amelynek egyik végén nagyon poláris —COO– csoport van.
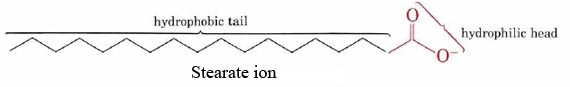
a hidrofób szénhidrogénlánc megpróbálja elkerülni a vizes közegekkel való érintkezést, míg az anionos csoport könnyen befogadja a vízmolekulák dipólusait és hidrogénkötéseit.
a sztearátionok hidrofób részeinek két fő módja, hogy elkerüljék a víz felhalmozódását a felületen, vagy kis mennyiségű olajban vagy zsírban oldódjanak (lásd a \(\PageIndex{2}\) ábrát ).,
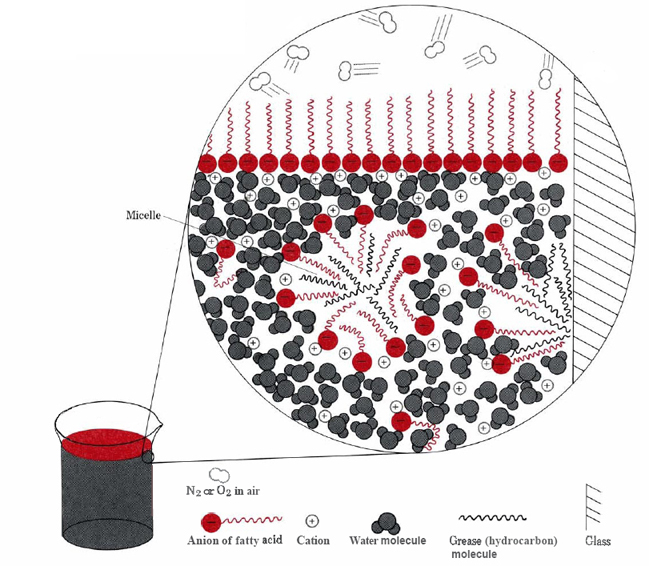
Ez utóbbi esetben a szappanmolekulák hidrofil fejei érintkeznek a zsíron kívüli vízzel, ami egy micelle néven ismert szerkezetet képez. Mivel a micellák külső része negatív töltésű, taszítják egymást, és megakadályozzák a zsírcseppek rekombinációját., A zsír ezért a vízben fel van függesztve (emulgeálva), és könnyen lemosható.
a természetes szappanokat, például a nátrium-sztearátot eredetileg az otthonban készítették az állati zsír fa hamuval történő melegítésével, amely hamuzsírt tartalmazott, K2CO3. A nagy mennyiségeket továbbra is iparilag állítják elő, de jelentős mértékben a szappanokat mosószerekkel helyettesítették. Ez a szappanok nemkívánatos viselkedésének következménye a kemény vízben. A kalcium, a magnézium és más keményvíz kationok oldhatatlan vegyületeket képeznek a zsírsavak anionjaival kombinálva., Ez nyálkás csapadékot eredményez, és megakadályozza a szappanmolekulák emulgeálódását a zsírban, kivéve, ha nagy felesleget használnak.
Mosószerek, mint alkylbenzenesulfonates (ABS), valamint a lineáris alkylbenzenesulfonates (LAS) a struktúrák nagyon hasonló-nátrium-sztearát, kivéve, hogy a feltöltött csoport a hidrofil feje —SO3– csatolni kell a benzol gyűrű. Az ABS-tisztítószereknek metil (CH3) csoportjai is vannak, amelyek elágazják szénhidrogénláncaikat.,
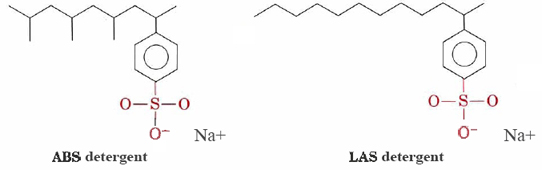
ezek a molekulák nem csapódnak ki keményvizes kationokkal, ezért jobban alkalmasak ruhamosásra. A LAS detergensek az ABS-t a hatvanas évek közepén váltották fel, amikor kiderült, hogy az utóbbiak nem biológiailag lebonthatók. A folyókat, sőt a csapvizet is szennyezőanyaggal és habbal borították. Úgy tűnik, hogy a természetes zsírok és zsírsavak elágazó szénhidrogénláncainak lebontására kifejlesztett mikroorganizmusok enzimjei képtelenek voltak megemészteni az ABS molekulák elágazó láncait., A LAS detergensek, bár az emberek gyártják, utánozzák a természetben előforduló molekulák szerkezetét, és biológiailag lebonthatók.