Bevezető
az Elektronok nem fix pozíció az atomok, vegyületek, illetve molekulák (lásd a lenti képet), de van valószínűsége, hogy megtalálják az egyes terek (elektronpályák). A rezonancia formák a nagyobb valószínűségek (elektronsűrűség) területeit szemléltetik. Ez olyan, mintha a kalapját a jobb kezében vagy a bal kezében tartaná. A rezonancia kifejezést akkor alkalmazzák, ha két vagy több lehetőség áll rendelkezésre., A vegyészek Lewis-diagramokkal ábrázolják a kovalens entitások, például molekulák és poliatomikus ionok szerkezetét és kötődését. Sok molekula Lewis-diagramja azonban nem felel meg a molekula megfigyelt tulajdonságainak.
példa \ (\PageIndex{1}\): Nitrátion
a nitrátion Lewis-diagramja szerint kétféle nitrogén-oxigén kötéssel, egy kettős kötéssel és két egyetlen kötéssel rendelkezik, ami arra utal, hogy a nitrátionban egy nitrogén-oxigén kötés rövidebb és erősebb, mint a másik kettő., A Lewis-szerkezet a formális töltés tekintetében azt is jelenti, hogy a nitrátionban kétféle oxigénatom van, az egyik formálisan semleges, a másik kettő pedig -1 formális töltéssel rendelkezik. Kísérletileg azonban a nitrátionban lévő három nitrogén-oxigén kötés azonos kötési hosszúságú és azonos kötési energiával rendelkezik, és a három oxigénatom megkülönböztethetetlen. A Lewis-diagram nem magyarázza meg kielégítően a nitrátion szerkezetét és kötését.
A nitrátionhoz két további Lewis-diagramot lehet rajzolni.,
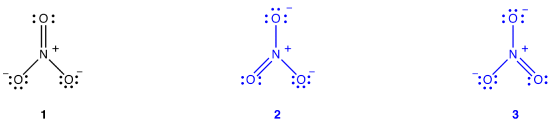
azonban egyikük sem felel meg a nitrátion megfigyelt tulajdonságainak, ezért nem ábrázolja megfelelően a nitrátionot.
Például a \(\PageIndex{2}\): Benzol
Benzol szerint a Lewis diagram, két típusú szén-szén kötések, három kettős kötések három egységes kötvények, ami arra utal, hogy minden három szén-szén kötések a benzol rövidebb, de erősebb, mint a többi három. Kísérletileg azonban a benzolban lévő hat szén-szén kötés azonos kötési hosszúsággal és azonos kötési energiával rendelkezik., A Lewis-diagram nem magyarázza meg kielégítően a benzol szerkezetét és kötését.
azoknak a molekuláknak az attribútuma, amelyeknek a klasszikus Lewis-diagram nem felel meg a megfigyelt tulajdonságoknak, az, hogy más érvényes Lewis-diagramok is előállíthatók számukra. Egy további Lewis diagramot lehet levonni a benzolhoz.

azonban egyikük sem felel meg a benzol megfigyelt tulajdonságainak, ezért nem megfelelően ábrázolja a benzolt.,
a rezonancia-elmélet egy faj, például a nitrátion vagy a benzol szerkezetének magyarázatára tett kísérlet, amelynek Lewis-diagramja nem felel meg a faj megfigyelt tulajdonságainak. A rezonancia elmélet fő előnye, hogy bár szigorú matematikai elemzésen alapul, a rezonancia elmélet sikeresen alkalmazható, kevés vagy egyáltalán nem matematikai hivatkozással. A rezonancia elméletet az alábbiakban ismertetjük a nitrátion példájaként.
a rezonancia elmélet szerint a nitrátion szerkezete nem 1, sem 2, sem 3, hanem mindhárom átlaga, stabilitással súlyozva., Az 1., 2. és 3. Lewis-diagramokat a nitrát-ion rezonancia formáinak, rezonancia struktúráinak vagy rezonancia-hozzájárulóinak nevezzük. A nitrátion szerkezete állítólag rezonancia hibrid, vagy egyszerűen az 1, 2 és 3 rezonancia-formák hibridje. Amikor a nitrátion szerkezetét meg kell mutatni, az 1, 2 és 3 rezonancia formákat rajzolják, kétfejű nyilakkal összekötve.,
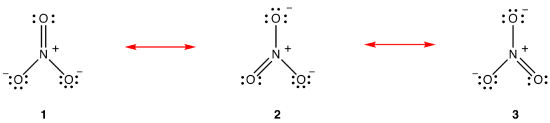
a nitrátion három rezonanciaformája (1, 2 és 3) azonos, tehát ugyanolyan stabilitással rendelkeznek, és ezért egyformán hozzájárulnak a hibridhez., Mivel a pontos mértéke az egyes rezonancia formája a nitrát-ion hozzájárul ahhoz, hogy a hibrid ismert, a bond rend minden nitrogén-oxigén bond, valamint a vádemelés minden oxigén atom a hibrid lehet könnyen meghatározni:
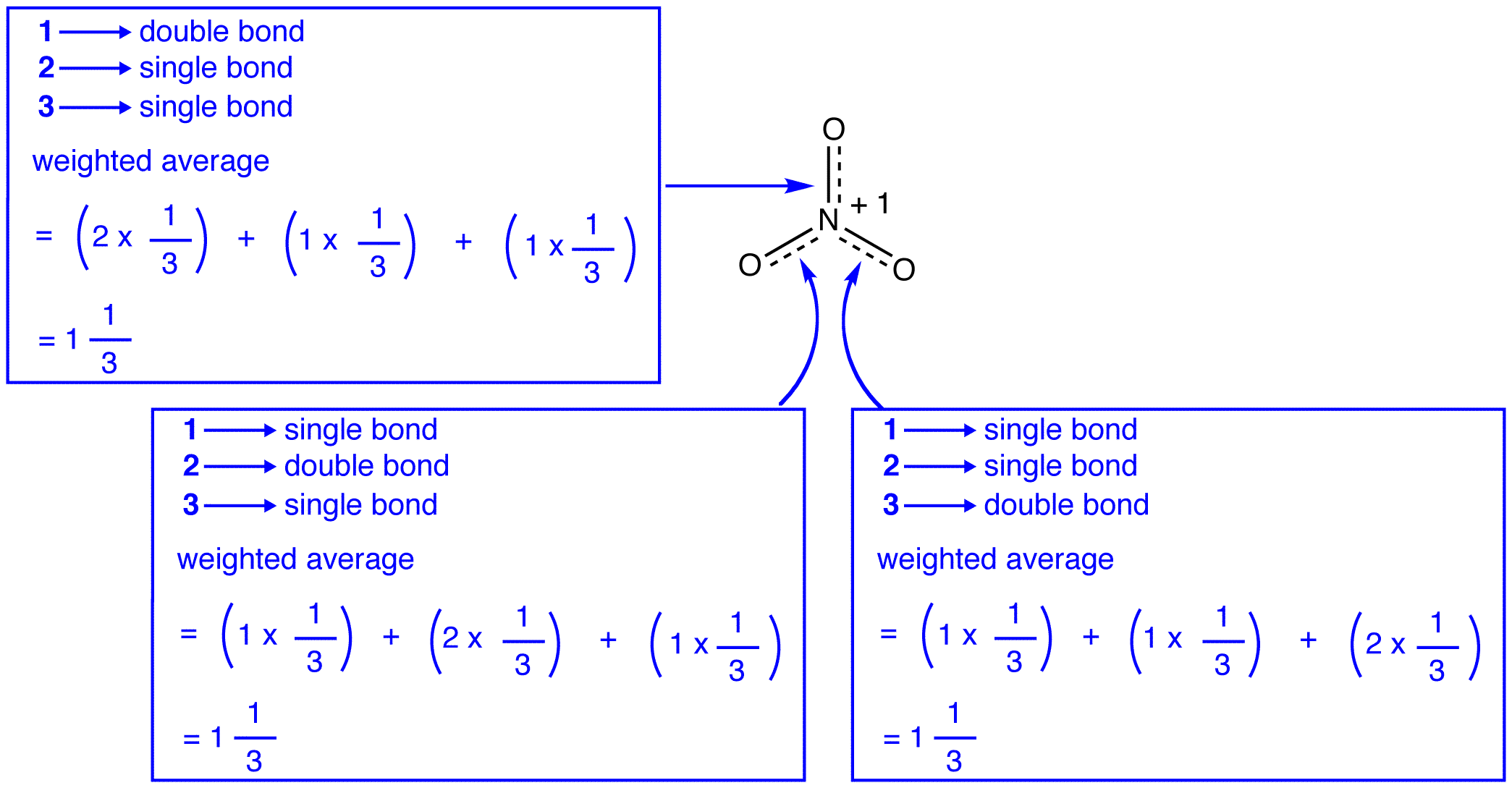
Szerint rezonancia elmélet, minden kötelék, a nitrát ion az egyik, majd a harmada, a kötvény, ami összhangban van a megfigyelés, hogy a három kötvények a nitrát-ion ugyanaz a bond-hossz, valamint az azonos bond energia.,
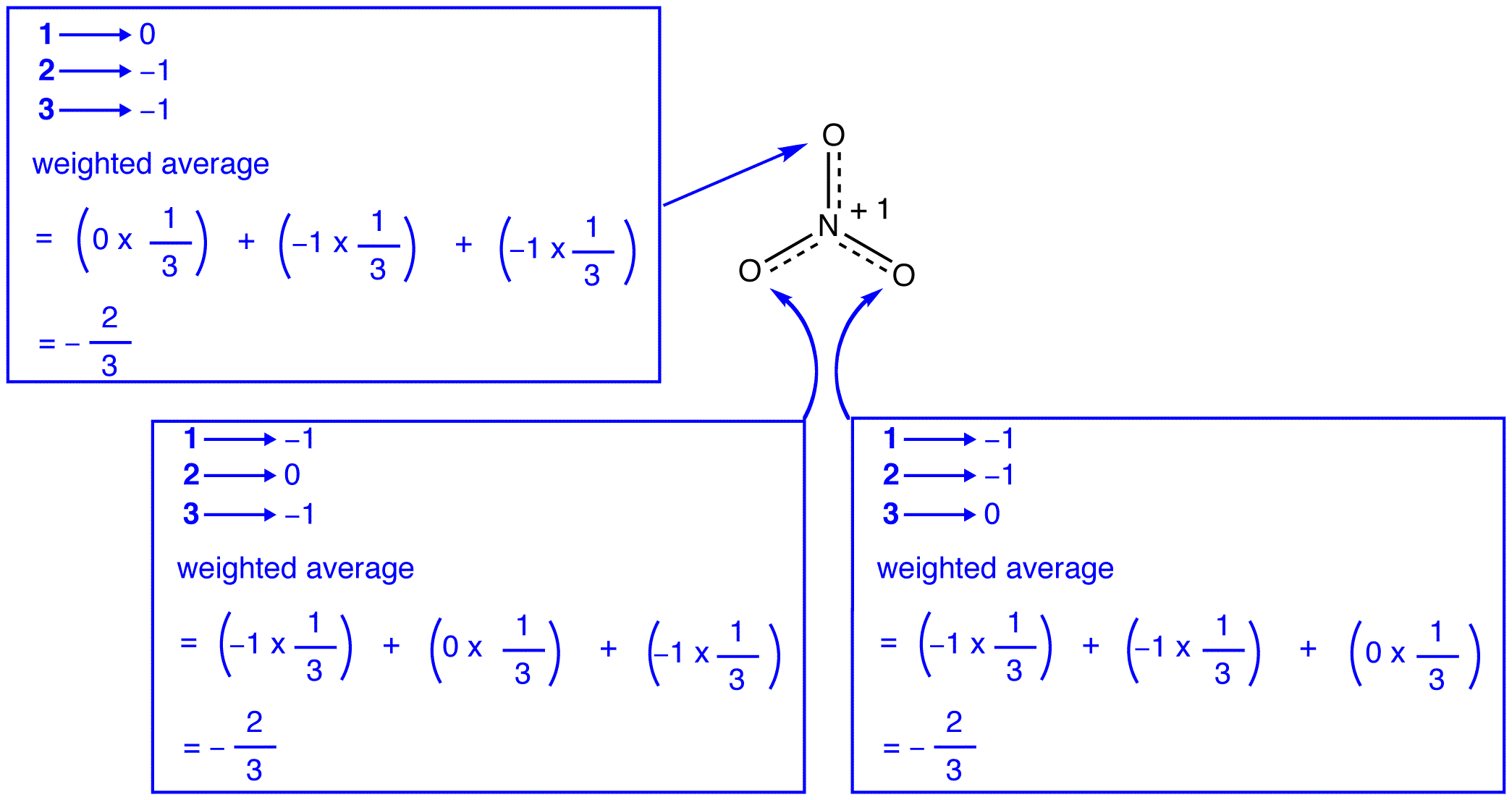
Szerint rezonancia elmélet, minden oxigén atom a nitrát ion hivatalos felelős -2/3, amely összefüggésben azzal a ténnyel, hogy a három nitrogén-oxigén kötvények azonos, megegyezik a megfigyelés, hogy a három oxigén atomok a nitrát-ion vagy megkülönböztethetetlen. A nitrátion minden egyes rezonanciaformájában két\ (\pi\) elektron van, amelyeket csak két atom oszt meg. Azt mondják, hogy egy elektron, amelyet csak két atom oszt meg, lokalizálódik., Így a két \(\pi\) elektron a nitrát-ion minden rezonancia formájában lokalizálódik. A nitrát-ion által képviselt hibrid, két \(\pi\) az elektronok:
- # elektronok egy \(\pi\) bond = 2
- # elektronok között, egy harmadik a \(\pi\) bond = 2/3
- # elektronok a hárman = 3 x (2/3) = 2
A két \(\pi\) az elektronok a nitrát-ion által megosztott összesen négy atomok, egy nitrogén atom három oxigén atomok. Azt mondják, hogy egy elektron, amelyet több mint két atom oszt meg, delokalizálódik. Így a nitrátionban lévő két \(\pi\) elektron delokalizálódik., A nitrátionban lévő \(\pi\) elektronok delokalizációja megköveteli, hogy a négy atom ugyanazon a síkon legyen, lehetővé téve a P pályák oldalirányú átfedését.,

Ha az energia, a nitrát-ion volt a súlyozott átlaga, az energiák a három rezonancia formája, csakúgy, mint a szerkezet a nitrát-ion a súlyozott átlaga, a struktúrák, a három rezonancia formában, de meg kell egyeznie az energia, az egyik a három azonos rezonancia formái:

Ha az energia, a hibrid volt egyenlő, hogy a rezonancia formában, tekintettel arra, hogy minden kémiai entitásokat (elemi részecskék, atomok, molekulák, stb.,) természetesen általában a lehető legalacsonyabb energiaállapotban vannak, nem lenne előnye, hogy a nitrátion hibridként létezzen; egyszerűen rezonancia formában létezhet. Mivel a nitrátion hibridként létezik, nem rezonancia formaként, arra lehet következtetni, hogy a hibrid energiája alacsonyabb, mint bármelyik rezonancia formáé.

a rezonancia elmélet szerint a molekula energiája alacsonyabb, mint a legalacsonyabb energiájú rezonancia formáé., Mivel a nitrátion alacsonyabb energiával rendelkezik, ezért stabilabb, mint bármely rezonancia formája, a nitrátionról azt mondják, hogy rezonancia stabilizált.
Közös Tévhitek
két tévhit van a rezonancia elméletről a kezdő hallgatók körében, valószínűleg a szó rezonancia szó szerinti értelmezése miatt. Az alábbiakban ismertetjük őket, példaként a nitrátionot használva.
1. tévhit: a nitrátion egy pillanatra rezonancia formában létezik 1, majd a 2. rezonancia formára vagy a 3. rezonancia formára változik, amely interkonvertálódik, vagy visszatér 1-re.,

a nitrátion szerkezete nem 1, sem 2, sem 3, hanem a hibrid, és nem változik idővel, csak reakció közben.
2. tévhit: a nitrátionok mintájában egy adott pillanatban az ionok egyharmada rezonancia formában létezik 1, egy másik egyharmada rezonancia formában 2, a fennmaradó egyharmada pedig rezonancia formában 3.

egy nitrátionok mintájában egy adott pillanatban minden ionnak azonos szerkezete van, amely a hibrid.,
öszvérek és orrszarvúk
a két tévhit tisztázására használt klasszikus analógia az öszvér (Morrison, R. T.; Boyd, R. N. Organic Chemistry, fifth edition; Allyn and Bacon: Boston, 1987, pg. 373). Biológiailag az öszvér egy ló és egy szamár hibridje. Ez nem jelenti azt, hogy egy öszvér egy pillanatra hasonlít egy lóra, majd megváltozik, hogy hasonlítson egy szamárra. Az öszvér megjelenése a ló és a szamár megjelenésének kombinációja,és az idővel nem változik. Az sem jelenti azt, hogy egy csordában néhány öszvér hasonlít egy lóra, a másik pedig egy szamárra., Egy csordában minden öszvérnek ugyanaz a megjelenése, ami egy ló és egy szamár kombinációja. Ennek az analógiának a gyengesége, hogy léteznek lovak és szamarak, míg a rezonancia formák szigorúan hipotetikusak. Egy jobb analógia, idézett Morrison és Boyd, az orrszarvú. Egy orrszarvú láttán úgy lehetne leírni, mint egy sárkány és egy egyszarvú hibridjét, két nem létező lényt.