Introduction
le diabète sucré de Type 2 (DT2) se caractérise par une résistance à l’insuline, qui reste relativement stable tout au long de la maladie, et une perte progressive de la fonction des cellules β Avec une sécrétion insuffisante d’insuline., En raison de cette évolution progressive, la plupart des patients atteints de T2DM auront éventuellement besoin d’insuline pour atteindre et maintenir le contrôle glycémique, en utilisant une approche progressive commençant par l’insuline basale associée à des agents oraux. Lorsque la glycémie pré-prandiale et postprandiale n’est pas suffisamment contrôlée, un régime d’insuline deux fois par jour avec NPH (Protamine neutre Hagedorn) ou des préparations d’insuline prémélangées est préféré comme étape suivante., Comme chez les sujets diabétiques de type 1, l’insulinothérapie en bolus basal doit être indiquée chez les patients T2DM présentant un déficit en insuline sévère qui ne sont pas en mesure d’atteindre et de maintenir les objectifs glycémiques avec un régime deux fois par jour.1 cependant, ce régime d’insuline est clairement sous-utilisé probablement en raison de la réticence des patients et des médecins en raison de la complexité impliquée dans sa mise en place ainsi que du peu d’informations disponibles sur la faisabilité, en particulier chez les sujets âgés, et son efficacité chez les patients précédemment traités avec deux doses d’insuline.,2
dans la présente étude, nous avons évalué la faisabilité, l’efficacité et l’innocuité de l’insulinothérapie en bolus basal chez des patients atteints de diabète de type 2 à long terme et d’un contrôle glycémique faible ou instable.
matériel et méthodes
dans cette étude prospective en un seul centre, nous avons inclus 37 patients qui ont été passés à l’insuline en bolus basal d’octobre 2006 à octobre 2007 et qui avaient présenté un contrôle glycémique instable ou médiocre (hémoglobine glyquée (HbA1c)≥8%) au cours des six mois précédents, malgré les interventions visant à l’améliorer., Le protocole d’étude a été approuvé par les comités d’éthique de l’établissement et un consentement écrit éclairé a été obtenu de tous les patients.
dans le traitement initial, les glucides ont été répartis dans les trois repas principaux. La dose initiale d’insuline glargine a été calculée à 50% de la dose quotidienne totale précédente et l’insuline prandiale initiale (asparte ou lispro) à 50% de la dose quotidienne totale, qui a été divisée également pour couvrir les trois repas., Les Patients qui prenaient de la metformine avant de changer de traitement et ne présentaient aucune contre-indication à celle-ci, ont continué à l’utiliser à la même dose. Les autres médicaments antidiabétiques oraux ont été arrêtés.
Tous les patients ont suivi un programme de formation externe structuré sur le diabète consistant en trois séances de groupe de 2 heures en une semaine pour 5 à 8 patients. En général, on leur a appris à suivre un régime en supposant un apport qualitatif en glucides à chaque repas, bien que pour les patients qui souhaitaient le varier, il fallait compter les glucides., Les Patients ont également appris la gestion de la thérapie basale-bolus et comment ajuster les doses d’insuline basale en fonction de l’auto-surveillance de la glycémie à jeun (SMBG) tous les 7 jours. L’ajustement de la dose d’insuline prandiale a été effectué en fonction des valeurs pré-repas à l’aide d’un algorithme simple avec des doses définies d’insuline à action rapide. Les Patients ont suivi les visites fournies par l’infirmière à 1 et 3 semaines, 3 et 6 mois, et par l’endocrinologue à 2, 4 et 7 mois, où le régime alimentaire a été vérifié et le journal avec les valeurs SMBG a été revu pour ajuster les doses d’insuline., Des données anthropométriques (Poids, Indice de masse corporelle et Tour de taille) ainsi que des variables thérapeutiques et biochimiques ont été obtenues à l’inclusion et à 3 et 6 mois chez tous les patients. Nous avons quantifié les besoins en insuline et le nombre d’hypoglycémie sévère (définie comme nécessitant une assistance) par l’anamnèse et un examen des journaux intimes des patients.
L’HbA1c a été déterminé par chromatographie liquide à haute performance (CLHP) (Bio-Rad Laboratories, Munich, Allemagne), avec une plage de référence de 4,6 à 5,8%., Le cholestérol et les triglycérides ont été déterminés par des méthodes enzymatiques standardisées et le cholestérol des lipoprotéines de haute densité (HDLc) par une méthode directe (Roche Diagnostics, Bâle, Suisse). Le cholestérol des lipoprotéines de basse densité (LDLc) a été estimé par la formule de Friedewald (si les taux de triglycérides étaient
3,39 mmol/L) ou par ultracentrifugation. L’apolipoprotéine (Apo) B a été déterminée par une méthode inmunoturbidimétrique (Roche-quant, Roche Diagnostics) et la taille des LDL par électrophorèse (2-16%)., La qualité de vie a été mesurée à l’aide d’un questionnaire spécifique à la maladie adapté en Espagne à partir du DCCT (Diabetes Quality of Life) à l’inclusion et répété 6 mois après l’insulinothérapie par bolus basal.3,4
Les données ont été analysées par le programme statistique SPSS 15.0 (SPSS Inc.). Les changements dans les variables anthropométriques, L’HbA1c, les besoins en insuline et le profil lipidique ont été évalués par t du test de Student. Ils ont été considérés comme des valeurs significatives de p≤0,05.
résultats
Les caractéristiques cliniques initiales sont résumées dans le tableau 1., Soixante-dix-huit pour cent des patients étaient sous traitement avec 2 doses de NPH ou de préparations d’insuline prémélangées, 11% des patients prenaient des médicaments oraux et de l’insuline au coucher (glargine, detemir ou NPH) et les 11% restants utilisaient d’autres régimes avec 3 doses de NPH et d’insuline régulière. Quatre-vingt-sept pour cent des patients présentaient une concentration D’HbA1c >8% et 51% présentaient une concentration d’HbA1c>9%. Après le passage au traitement par bolus basal, L’HbA1c a chuté de 9±1,2% à 8,1±1,2% (p
0,001) à 3 mois et à 8,0±1,2% à 6 mois (p0.001) (Tableau 1, fig. 1)., Le pourcentage de patients présentant une HbA1c≥9% est passé d’un taux initial de 51% (19 sujets) à 13,8% et 18,9%, respectivement à 3 et 6 mois. Figue. 2 montre la proportion de patients présentant un HbA1c7%, 7-8% et >8% avant et après le passage au traitement par bolus basal. Cinq des patients ont montré une aggravation des valeurs D’HbA1c. Un seul épisode d’hypoglycémie sévère a été enregistré. À 6 mois, Tous les patients ont pu ajuster la dose d’insuline basale, mais seulement 10 patients ont modifié la dose prandiale en fonction des schémas de SMBG de manière autonome.,
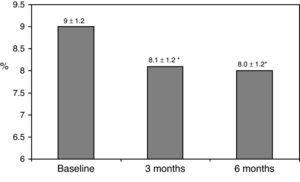
Glycated hemoglobin at baseline and 3 and 6 months after switching to basal-bolus regimen. *p0.001 compared to baseline. HbA1c: glycated hemoglobin.
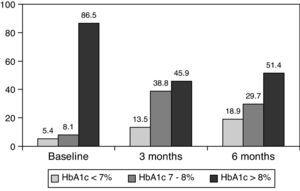
Percentage of patients with glycated hemoglobin 8% at baseline, and 3 and 6 months after switching to basal-bolus regimen.
le poids corporel, les besoins en insuline et les paramètres lipidiques à l’inclusion et pendant le suivi sont indiqués dans le tableau 1. Le poids corporel est resté stable pendant les 6 mois de suivi et les besoins en insuline (UI / kg / jour) n’ont pas changé à 3 mois et ont légèrement augmenté à 6 mois. La taille des particules LDL a augmenté significativement à 3 (25,77±0,48 nm vs 25,98±0,5 nm, p0.05) et 6 mois (25,77±0,48 nm vs 25,94±0,44 nm, p0.05), alors que les autres paramètres lipidiques n’ont pas changé.,
Discussion
dans la présente étude, nous avons montré que l’insulinothérapie en bolus basal permet d’améliorer le contrôle glycémique sans compromettre la sécurité et la qualité de vie chez les sujets atteints de diabète de type 2 à long terme, préalablement traités avec une ou plusieurs doses d’insuline. Nous démontrons également la faisabilité de la mise en œuvre de ces régimes d’insuline par le biais d’un programme de formation externe structuré.,
des lignes directrices consensuelles pour la gestion du diabète de type 2 considèrent que les principaux objectifs du traitement sont de parvenir à un taux d’HbA1c des concentrations aussi faibles que possible sans causer inacceptable hypoglycémie, en particulier chez les patients âgés ou souffrant de maladies coronariennes, et de prévenir le développement de complications microvasculaires et macrovasculaires.1,5 malheureusement, des enquêtes récentes indiquent qu’une grande proportion de patients diabétiques ne parviennent pas à atteindre les objectifs glycémiques recommandés.,6,7 bien que dans L’Enquête nationale sur l’examen de la santé et de la Nutrition (NHANES), la proportion de patients atteints d’HbA1c
7% soit passée de 37% en 1999-2000 à 56,8% en 2003-2004, les taux de contrôle glycémique sous-optimal sont particulièrement élevés chez les personnes ayant des caractéristiques similaires à celles étudiées par nous, qui ont,6,7 des doses deux fois par jour de NPH ou d’insuline prémélangée sont utilisées pour simplifier les régimes d’insuline, mais ont une flexibilité limitée, nécessitent une adhérence rigide aux repas réguliers, limitent la capacité d’ajuster les doses des composants individuels et augmentent le risque d’hypoglycémie. Ainsi, bien que de nombreux patients obtiennent initialement un contrôle glycémique adéquat avec ce régime,8 lorsque la capacité de sécrétion d’insuline des cellules bêta est perdue et que le déficit en insuline est sévère, le contrôle glycémique devient médiocre et instable, comme chez la plupart des patients inclus dans la présente étude.,1,8 nous avons montré que chez les patients atteints de diabète de type 2 à long terme, mal contrôlés par d’autres régimes d’insuline et de profil instable, le régime d’insuline basal-bolus réduit L’HbA1c d’un point sur 6 mois et la proportion de patients atteints d’HbA1c≥9% de 51% à 14% C’est probablement parce qu’il s’agit d’une thérapie plus physiologique; alors que l’insuline prandiale remplace la sécrétion endogène d’insuline de première phase, l’insuline basale diminue le niveau d’hyperglycémie à jeun., Ainsi, en plus du niveau D’HbA1c 9, la façon dont le traitement est intensifié modifie considérablement les contributions relatives de l’hyperglycémie basale et postprandiale à l’hyperglycémie globale des patients T2DM. Récemment, l’Énigme et coll.10 a montré qu’après l’intensification du traitement par l’insuline, la contribution de l’hyperglycémie basale diminue mais représente toujours environ un tiers de l’hyperglycémie restante. Par conséquent, selon les conclusions de la présente étude, l’utilisation de schémas insuliniques combinant basale avec l’insuline prandiale seront souvent nécessaires pour atteindre les objectifs glycémiques., En fait, ces résultats sont cohérents avec les nombreuses preuves des avantages du traitement par bolus basal dans le diabète de type 1 11 et sont étayés par les données limitées des études observationnelles chez les patients atteints de diabète de type 2 passant du prémélange au traitement à base de glargine à base de bolus basal 12,13 et par une comparaison randomisée entre un traitement à base de prémélange et un traitement à base de bolus basal chez les patients diabétiques de type 2.2,14,15 chez les patients précédemment traités par glargine plus antidiabétiques oraux, la différence D’HbA1c était de 0.,22% en faveur du régime à base de glargine en bolus basal, par rapport à un régime d’insuline prémélangé15. Dans L’étude PREFER14, le sous-groupe de patients ayant précédemment suivi un traitement par insuline basale a montré une réduction plus importante de L’HbA1c avec le traitement par bolus basal detemir/aspart par rapport à l’insuline biphasique aspart (-1,21% vs -0,75%). Enfin, chez les patients diabétiques de type 2 traités par prémélange, Fritsche et al. a montré qu’un schéma insulinique à base de glargine/glulisine en bolus basal était supérieur à un schéma insulinique prémélangé dans la réduction de L’HbA1c (-1,31% vs 0,8%).,2 par conséquent, bien qu’il existe des différences dans l’ampleur de l’amélioration entre les études, probablement en raison des différentes caractéristiques de base de la population étudiée, la supériorité d’un régime basal-bolus chez des patients sélectionnés atteints d’une maladie de longue date semble démontrée. La réduction de plus d’un point D’HbA1c obtenue par le passage à un régime d’insuline en bolus basal peut être considérée comme cliniquement significative car elle peut entraîner une réduction des résultats cliniques., Malheureusement, la thérapie basale-bolus est sous-utilisée chez les patients atteints de T2DM car les médecins la considèrent complexe à mettre en œuvre, elle prend du temps et on craint l’augmentation du nombre d’injections, le risque d’hypoglycémie, la prise de poids et la détérioration de la qualité de vie. Dans cette étude et dans les études précédentes,le poids corporel et le taux d’hypoglycémie sévère n’ont pas augmenté,2, 12, ce qui pourrait être lié à la substitution plus physiologique de l’insuline par le régime basal-bolus et à la flexibilité que ce traitement peut offrir aux patients., Ainsi, la peur de l’hypoglycémie ne devrait pas être un obstacle pour commencer ce type de traitement dans T2DM, mais elle doit être considérée afin d’établir des cibles de contrôle glycémique car elle peut provoquer une morbidité et une mortalité accrue.16 en ce qui concerne l’impact sur la qualité de vie, en concordance avec le rapport de Ménard et coll.,17 notre étude n’a pas soutenu l’opinion selon laquelle les régimes de bolus basal conduisent à une diminution de la qualité de vie.
selon un rapport précédent12, dans la présente étude, tous les patients ont pu titrer leur dose d’insuline basale en fonction du SMBG à jeun des 3 à 7 derniers jours., En revanche, peu de patients étaient en mesure d’ajuster les doses d’insuline prandiale en fonction des schémas de SMBG et la plupart avaient besoin du support d’un algorithme simple avec une dose définie en fonction de la glycémie préméale. Cela n’est pas surprenant, car l’établissement de la dose optimale d’insuline au moment des repas implique souvent des calculs tenant compte de plusieurs facteurs et est difficile pour certains patients. De plus, l’utilisation d’un algorithme simple pour ajuster l’insuline à action rapide au moment des repas chaque semaine en fonction des schémas SMBG est aussi efficace que l’ajustement de l’insuline au moment des repas en utilisant des ratios insuline / glucides chez les sujets T2DM.,18
Les Limites de l’étude sont liées au plan d’observation prospectif et à l’absence de groupe témoin. Ces aspects et le suivi court des patients, difficile d’interpréter les résultats et leur applicabilité aux patients atteints de T2DM suivis dans d’autres centres. Cependant, bien que de futures études sur des groupes plus importants de patients devraient être effectuées pour confirmer ces résultats, l’étude fournit des informations qui peuvent être utiles pour la prise en charge d’une situation clinique commune et mal traitée.,
En conclusion, la présente étude a démontré qu’un programme ambulatoire de 9 heures permettait aux patients atteints de DT2D de longue durée mal contrôlés par d’autres régimes d’insuline de passer à un régime d’insuline en bolus basal. Nous avons également confirmé que le régime d’insuline en bolus basal est efficace, sûr et n’altère pas la qualité de vie de ce sous-groupe de patients atteints de DT2. Ainsi, un traitement basal-bolus pourrait être proposé aux sujets T2DM insuffisamment contrôlés par d’autres stratégies insuliniques.
conflit d’intérêts
Irene Vinagre a reçu des honoraires de conférences D’Eli Lilly, Novo Nordisk et Sanofi Aventis., Antonio Perez a reçu des honoraires de con sulting et de conférence D’Eli Lilly, Novo Nordisk et Sanofi Aventis.